
《ICH E2F:研发期间安全性更新报告指导原则》自2019年11月5日正式实施以来,来自申请人之窗的一般性技术问题咨询与其他咨询通道中收集到的问题逐渐增多。为进一步指导申办者规范撰写并递交符合ICH E2F与中国区域实施要求的DSUR,指导原则工作组经过系统梳理,就比较集中的共性问题开展讨论,现形成了《研发期间安全性更新报告常见问答(征求意见稿)》。
我们诚挚地欢迎社会各界对征求意见稿指出宝贵意见与建议,并及时反馈给我们,以便后续改进。征求意见时限为自发布之日起一个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:姚珠星,崔欢欢
联系方式:yaozhx@cde.org.cn, cuihh@cde.org.cn,
感谢您的参与与大力支持。
国家药品监督管理局药品审评中心
2025年9月17日
一、前言
国家药品监督管理局于2019年11月公布实施《ICHE2F:研发期间安全性更新报告指导原则》(以下简称E2F)。研发期间安全性更新报告(Development Safety Update Report, DSUR)的主要目的是对报告周期内收集到的与试验药(无论上市与否)相关的安全性信息开展全面深入的年度通过了解与评估。为贯彻落实《药品注册管理措施》中关于DSUR的工作要求,国家药品监督管理局药品审评中心(以下简称药审中心)于2020年7月1日发布《研发期间安全性更新报告管理规范(试行)》,进一步弄清楚了DSUR的区域性要求。
为进一步指导申办者规范撰写并递交符合ICHE2F与中 国区域实施要求的DSUR,指导原则工作组系统梳理来自申 请人之窗的一般性技术问题咨询与其他咨询通道中收集到 的诸多问题,就比较集中的共性问题开展整理形成常见问答,希望起初起初研发单位加强对指导原则的理解。
| 相关要求 | 境内实施日期 |
| 《ICH E2F:研发期间安全性更新报告指导原则》 | 2019年11月5日 |
| 《研发期间安全性更新报告管理规范(试行)》 | 2020年7月1日 |
二、DSUR相关问答
(一)DSUR的递交范围
1.需要递交DSUR的药物与临床试验范围都包括哪些?
答:申办者获准在境内开展药物临床试验后均应向药审中心提交DSUR。
药物包括与注册申请密切相关的中药、化药、生物制品。临床试验包括与注册申请密切相关的I、II、III期临床试验,按照IND(InvestigationalNewDrug)申请批准开展的生物等效性试验(BE),批件中有特别要求的IV期临床试验,附条件批准的药品需按要求完成的临床试验,已上市产品申请增加新的人群或新的适应症需要开展的临床试验,以及已上市品种因重大改变(如,新剂型,新给药途径,新生产工艺),需要开展的临床试验。
2.哪些类型的临床试验不需要递交DSUR?
答:为开展化学药品仿制药一致性评价,仅以备案形式开展的BE试验,原则上不需要递交。若同时存在其他需要递交DSUR的临床试验情形,应予以递交。
3.既往药物临床试验是否需要递交DSUR?
答:2018年7月27日国家药监局发布《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》(2018 年50号)(以下简称50号公告),公告事宜包括“申请人在获得首次临床试验许可后,应定期向药审中心提供药物研发期间安全性更新报告,包括全球研发与上市状况、正在开展中与已完成的临床试验、新增的安全性结果、重大生产变更、整体安全性评估、重要风险总结、获益-风险评估与下一年总体研发计划等内容。”
对于50号公告之前获准开展临床试验的品种,原则上由申办者自行决定是否递交DSUR。若一致有效成分/一致处方在50号公告发布之后获准开展新的临床试验,则应递交DSUR。
4.药物临床试验获批后,尚未启动临床研究,是否可不予递交DSUR?若申办者因策略调整终止在境内研发,此种情况下,申办者是否需要递交DSUR?
答:报告周期内尚未开展临床试验,申办者也应以药物临床试验在境内或者全球首次获得临床试验许可日期(即“国际研发诞生日”,以下简称DIBD)月与日,作为年度报告周期的起始日期。首次提交应在境内临床试验获准开展后第一个DIBD后两个月内完成,后续提交也应以DIBD为基准。直至在境内研发终止。不可省略或者以简要说明替代。
若药物境内终止研发日期距临床试验获批日期或研究周期短于一年,申办者可不递交DSUR。申办者应及时更新药物临床试验登记与信息公示平台的试验状态,说明终止临床试验原因。
5.报告周期内未开展相关研究或活动,是否可省略DSUR相应的章节内容?
答:对于无进展/无发现的章节或者附件,应在相应项下开展说明,不应省略。
6.药物临床试验获批后,若中国境内没有开展临床试验,境外有正在开展临床试验,在向中国监管机构递交的DSUR里是否可不体现境外研究的相关数据?对于多剂型多适应症 的一致活性成分,若某剂型或者适应症的品种尚未开展临床试验,相关信息是否可不纳入DSUR?
答:DSUR应当包括报告周期内,申办者正在开展的该 品种所有临床试验的安全性信息,包括境内外所有研究数据。按照DSUR的一般原则,申办者在准备DSUR时,需要包括针对同一活性成分的所有剂型与规格、所有适应症以及研究 中接受研究药物的患者人群相关数据,临床试验数据与其他 重要数据。
(二)DSUR的报告起始时间
7.DSUR的报告起始时间如何界定?
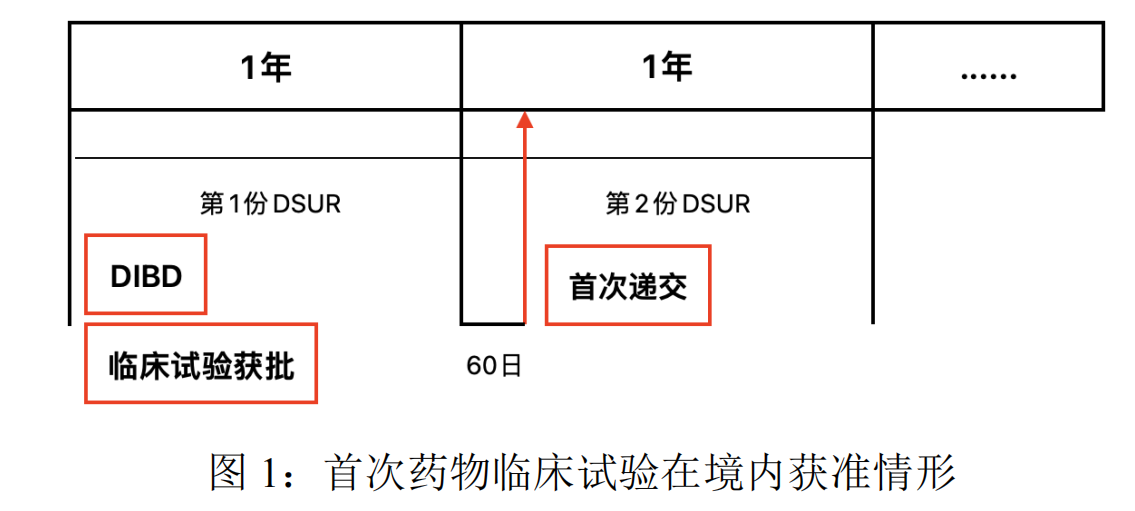
答:DSUR原则上应将药物临床试验在境内或DIBD的月与日,作为年度报告周期的起始日期,非境内临床试验的实施日期。数据找准点应是境内临床试验获准开展后的第一个DIBD月与日的前一天。报告周期不超过一年。首次递交应在境内临床试验获准开展后的数据找准点后60个日历日内,后续递交也应以DIBD为基准。
若首次药物临床试验在境内获准,即DIBD为境内临床试验获准日期。如图1所示,依照法规要求依次递交即可。
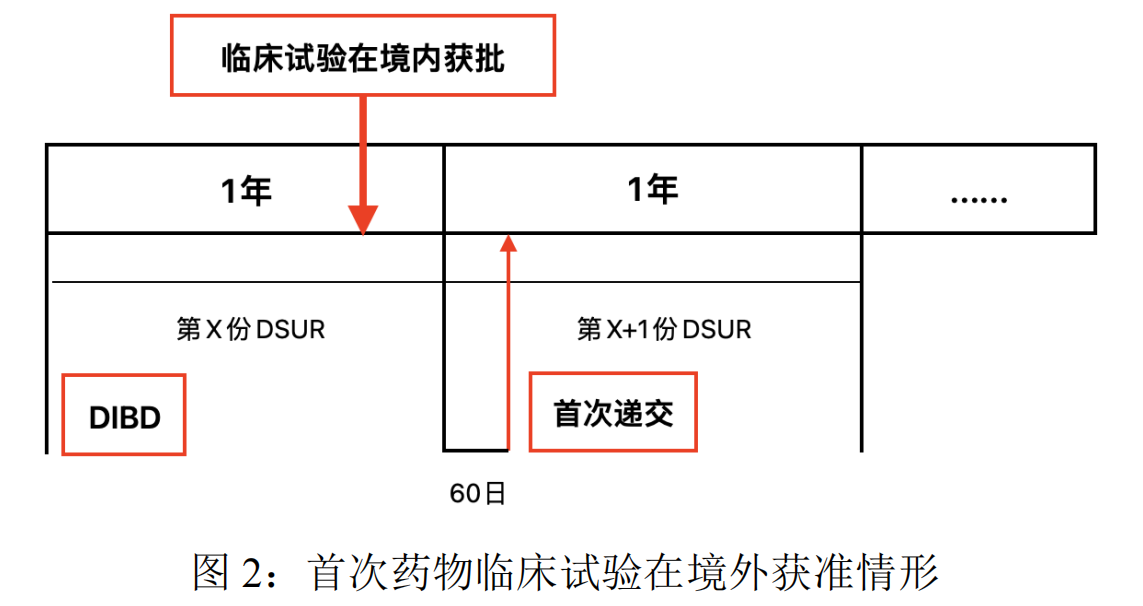
若首次药物临床试验在境外批准,即DIBD在前,境内临床试验批准日期在后。如图2所示,在第X份DSUR的报告周期内,国内获批临床试验,则应将第X+1份DSUR作为国内首次递交的DSUR,后续依次按照法规要求递交即可。
(三)DSUR的报告截止时间
8.《研发期间安全性更新报告管理规范(试行)》第七条规定:“DSUR应持续提交至该药物境内最后一个上市许可申请提交,或者在境内不再继续开展研发时为止。”如何界定DSUR的终止日期?
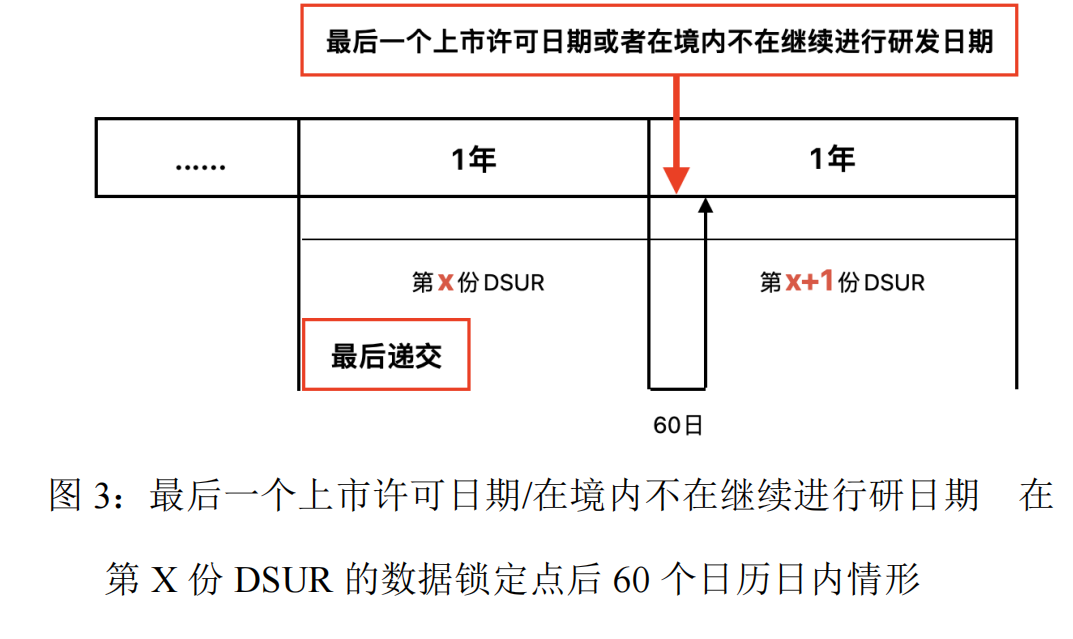
答:若最后一个上市许可申请日期或者在境内不再继续开展研发日期在第X份DSUR的数据找准点后60个日历日内,可将第X份DSUR作为最后一份DSUR,如图3所示。并请在“3.17 最新披露的信息”章节对数据找准点后、本DSUR准备期间出现的潜在重要安全性发现开展总结。整体安全性评估中(参考第3.18节)也应纳入这些更新信息。
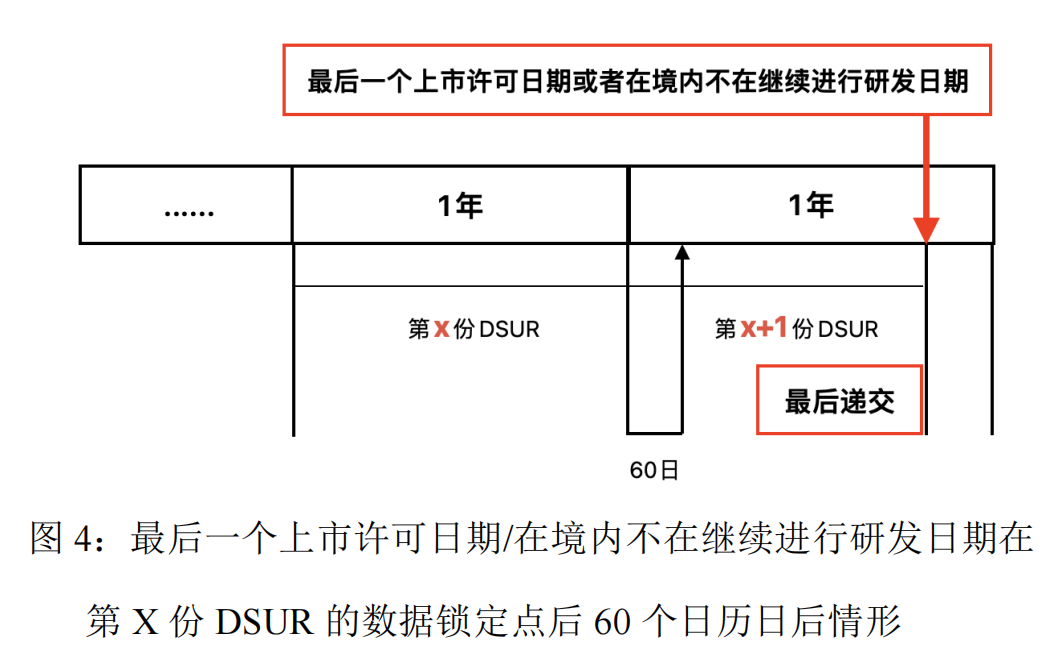
若最后一个上市许可申请日期或者在境内不再继续开展研发日期在第X份DSUR的数据找准点后60个日历日之后,则应提交第X+1份DSUR作为最后一份DSUR,如图4 所示,并附说明性文件。
9.递交境内最后一份DSUR及说明文件后,后续申办者重启该品种注册临床试验,是否仍需要递交DSUR?
答:建议申办者及早对品种的整体研究计划开展规划,做好临床研发周期内完整序贯的年度安全信息的评估与报告,落实药品全生命周期管理的法规要求。DSUR的递交依据品种在中国境内的临床试验获批与实际研发情况,若申办者终止临床试验后重启注册临床试验,仍需要递交DSUR。
10.长期随访如何处理?
答:对于主试验结束后,上市申请审评期间,或获批上市后仍在开展长期随访或者给药的试验,仍需递交DSUR至随访结束,即在境内不再继续开展研发。
(四)DSUR的递交主体
11.同一活性成分在中国境内有不同的在研项目,是否 可以按照受理号由不同注册代理机构分别递交一致的DSUR?或是由一个注册代理机构递交?同一活性成分涉及多个临床试验、多个申办者,是否需由各个申办者分别递交DSUR?
答:同一活性成分在中国境内有不同的在研项目,建议由一个注册代理机构递交一份完整的DSUR。若同一活性成分涉及多个临床试验、多个申办者,则这些申办者应尽量准备一份DSUR。若申办者评估确认无法只准备一份DSUR,也请分别提交。在各方研究的适应症、给药途径或剂型不同,可以按照基于这种方式。在此情况下,每份报告中应给出分别撰写DSUR的理由。
12.药物临床试验申办者出现变更后如何递交DSUR?
答:申办者应当定期在药品审评中心网站递交DSUR,申办者出现变更的,由变更后的申办者递交。在此情况下,建议同步提交变更说明。
(五)DSUR的递交方式与审核
13.申办者如何向药审中心递交DSUR,递交后是否会返回审核结论?
答:DSUR的递交途径为:【申请人之窗】-【临床试验期间安全性风险管理】-【研发期间安全性更新报告递交】。
药审中心按照相关工作程序在180个工作日内对DSUR 开展审核。DSUR应简明扼要,提供的信息应使监管机构确信申办者对试验药物安全性特征的进展开展了充分的监测与评估。然而,DSUR不应作为新的重要安全性信息的初始报告途径、也不应作为新的安全性问题的检出途径。
申办者可通过【申请人之窗】-【临床试验期间安全性风险管理】-【研发期间安全性风险沟通与反馈】或【通知书查询与反馈】栏目对DSUR的审核意见开展查阅与反馈。若药审中心在180个工作日内无反馈意见,可视为归档处理。
(六)联合用药时的特殊考虑
14.某在研品种A在境内外仅开展联合已上市药物B的临床试验,无单药临床试验。申办者是否可只提交B的DSUR (仍有在研临床试验),该报告包括(A)+(B)联合用药临床试验的安全性信息。
答:若(A)+(B)联合用药若属于固定组合产品(例如,该产品中至少含有可归结成两种固定剂量的活性成分,并以单一剂型给药),可递交一份DSUR。若申办者也同时在对固定组合产品的单个成分(一个或多个)开展临床试验,应为每个活性成分分别递交DSUR,在每份DSUR的第8.5节中总结其他DSUR的相关发现。以助于监管机构全面了解每个活性成分以及固定复方制剂的安全性。
(七)DSUR与PSUR的关系
15.境内已批准上市品种。若申办者重新开展本品在中国境内的新药临床试验,是否能以PSUR递交替代DSUR?是否可以将DSUR与PSUR的报告周期开展同步?
答:DSUR与PSUR的侧重点不同,涉及不同的周期与接收单位,不能彼此替代。对于重启注册临床试验的情形,申办者仍需按照法规要求递交DSUR。如申办者需要,可以在全球首个获得上市批准日期(即“国际诞生日”,简称IBD)的基础上准备与提交DSUR。调整后的首次提交,报告周期(数据找准点至IBD的月与日)不应超过一年(与E2F指南2.2节要求一致)。
(八)整体安全性评估撰写相关
16.“3.18.2 获益-风险考量”章节的是否需要提供有效性信息?
答:本节需从累积的安全性数据识别的风险与预期的获益之间的平衡开展简要说明,并说明上一次DSUR后该平衡是否出现了变化。建议申办者尝试补充试验药物有效性信息,以及有效性数据对于作出风险获益结论并采取风险最小化措施的支持,起初起初申办者与监管机构从获益-风险的整体角度对试验药物在报告周期内开展科学评价。若申办者在获益-风险评估过程中发现获益-风险平衡转为负面或存在重要安全性信号,请通过快速报告途径报告药审中心。
(九)区域附件
17.区域附件2“报告周期内死亡受试者列表”与区域附件3“报告周期内境内因任何不良事件而退出临试验的受试者列表”是否需要列明全球数据?
答:区域附件2与区域附件3与E2F指南所举示例基本一致,限定为境内数据,一般不需要递交全球数据。若递交全球数据,则应以适当方式清晰标注清楚境内数据。
18.区域附件4“报告周期内出现的药物临床试验方案变更或者临床方面的新发现、非临床或者药学的变化或者新发现总结表”的范围是什么?
答:区域附件4的范围应与境内获准开展的临床试验相关或与未来境内药品上市注册申请相关的内容。
19.区域附件2“报告周期内境内死亡受试者列表”中,提到“临床试验过程中境内死亡受试者列表应至少包括:受试者编号、治疗方案(可能仍处于盲态)以及每例受试者死亡的原因”。出于对受试者隐私的保护,以及境外其他区域信息保密的监管要求,申办者拟在区域附件2列表中包括研究编号、治疗方案、年龄、性别、种族、国家、死亡日期及死亡原因等信息,是否可不再列入受试者编号信息?
答:区域附件2为报告周期内中国境内死亡受试者列表,而非全球死亡受试者列表,不涉及境外死亡受试者信息。请参照《研发期间安全性更新报告管理规范》要求执行。
20.临床试验期间出现药学相关变更的是否通过DSUR报告即可?
答:按照《药品注册管理措施》第二十九条,药物临床试验期间,出现药学的变化或者有新发现的,申办者应当按照规定,参照相关技术指导原则,充分评估对受试者安全的影响。申办者评估认为不影响受试者安全的,可以直接实施并在研发期间安全性更新报告中报告。可能增加受试者安全性风险的,应当指出补充申请。申办者应当参照相关技术指导原则,对临床试验期间变更及其对受试者安全性的影响开展审慎评估。
(十)DSUR勘误相关
21.DSUR递交后,申办者发现需要递交勘误报告或补充信息,应如何递交?
答:可按照DSUR常规递交流程再次递交,同时,申办者应在附件中上传说明性文件。DSUR的递交时间以勘误报告或补充信息递交完成为准,即应当在其数据找准点后60个日历日内将完整准确的DSUR递交至药品审评中心。
三、参考文献
[1] 国家药品监督管理局. 关于调整药物临床试验审评审批程序的公告:2018年第50号[BE/OL]. (2018-07-24).
[2] 国家药品监督管理局. 研发期间安全性更新报告管理规范(试行):2021年第52号公告[BE/OL]. (2021-05-14).
[3]国家药品监督管理局. 关于适用《E1:人群暴露程度:评估非危及生命性疾病长期治疗药物的临床安全性》等15个国际人用药品注册技术协调会(ICH)指导原则的公告:201 9年第88号[BE/OL]. (2019-11-12).
[4]Heads of Medicines Agencies. Questions and answers t o the annual safety report –frequently asked questions reg arding the development safety update report (DSUR)[BE/OL]. (2011-12-22).
[5]International Council for Harmonisation. ICH E2F: Development Safety Update Report. [BE/OL]. (2010-09-09).



 1444
1444

