澳大利亚医疗器械注册(TGA认证)
服务价:¥面议


一、概述
澳大利亚治疗用品管理局(TGA) 是澳大利亚政府卫生部的一部分,负责监管治疗用品,包括处方药、疫苗、防晒霜、维生素与矿物质、医疗设备、血液与血液制品。几乎所有声称具有治疗功效的产品都必须登记在澳大利亚治疗用品注册簿(ARTG)中,才能在澳大利亚供应。
二、医疗器械分类
制造商需按照以下因素确定医疗器械的分类:
预期用途:制造商对器械的预期使用目的。风险等级:对患者、用户及其他人的风险水平(出现危害的概率及严重程度)。侵入性程度:器械在人体内的侵入程度。使用时限:器械的使用持续时间。
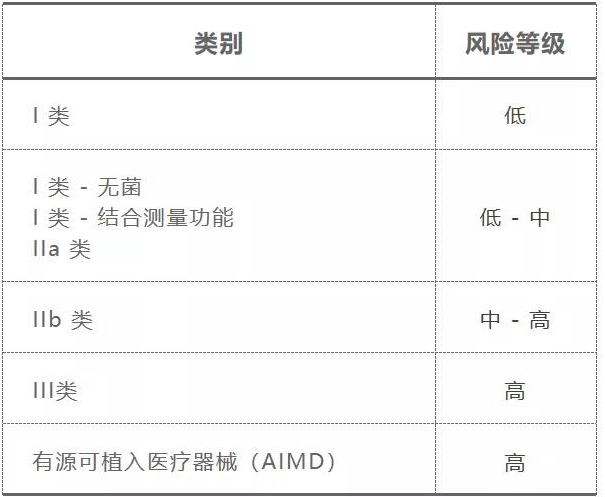
按照这些因素,医疗器械被分为不同的风险等级,具体分类如下:
三、符合性评估
1. 什么是符合性评估?
制造商必须能够证明其医疗器械及其制造过程符合澳大利亚的相关法规要求。相关法规包括:
《治疗用品法》1989年(Therapeutic Goods Act 1989, the Act)《治疗用品(医疗器械)法规》2002年(Therapeutic Goods (Medical Devices) Regulations 2002, the Regulations)
2. 符合性评估证据类型
TGA接受以下几种符合性评估证书作为证据:
TGA发表的符合性评估证书:这是某些制造商的唯一途径。澳大利亚-欧盟MRA符合性证书:按照澳大利亚与欧盟的互认协议(MRA)发表的证书。澳大利亚-EFTA MRA符合性证书:按照澳大利亚与欧洲自由贸易联盟(EFTA)的互认协议发表的证书。欧盟公告机构发表的EC证书:由欧盟公告机构(Notified Body)发表的证书。
3. 符合性评估所需材料
申请符合性评估时,制造商通常需要提交以下材料:
四、注册流程
确定分类:按照上述分类规则,确定医疗器械的风险等级。准备文件:按照分类要求,准备相应的技术文件、临床数据、质量管理体系文件等。选择符合性评估路径:按照产品分类与制造商情况,选择合适的符合性评估证书。提交申请:通过TGA在线系统提交注册申请,并支付相关费用。审核与批准:TGA将对提交的文件开展审核,审核通过后,产品将被登记在ARTG中,允许在澳大利亚市场销售。
提交留言