第二类医疗器械注册证延续
服务价:¥面议

第二类医疗器械注册证延续是保障医疗器械持续合规上市的根本监管机制,其以全生命周期质量管控为导向,通过动态审查确保产品在技术迭代与标准升级中始终符合安全性与有效性要求。按照《医疗器械监督管理条例》,注册人需在证书有效期届满6个月前向原注册部门提交申请,逾期或未通过审查将结果产品退出市场。延续注册不仅是对注册证效期的延长,更是对产品技术合规性(如是否符合新发布的强制性标准)、临床风险再评估(如附条件审批事项的完成度)及质量管理体系有效性的全面核查。例如,若产品无法满足新版国家标准或未履行注册证载明的义务(如补充临床试验),监管部门将不予延续。此外,新注册证有效期的起算方式灵活调整:若在原证有效期内获批,则新证自到期次日生效;若超期获批,则以批准日为起点,既维护了监管严肃性,又为企业提供操作弹性。这一机制推动企业形成持续改进机制,以应对医疗技术快速发展的挑战,巩固市场准入资格。
二类医疗器械注册证延续申报资料
1、 《医疗器械产品延续注册申请表》
(1)应有法定代表人或负责人签字并加盖公章;
(2)应与医疗器械注册证上对应内容一致(如有医疗器械注册变更文件,申请表中相应内容应填写变更后信息)。
2、证明性文件
(1)企业营业执照副本复印件,且应在有效期内;
(2)组织机构代码证复印件,且应在有效期内。
3、注册人关于产品没有变化的声明;
4、原医疗器械注册证复印件、历次医疗器械注册变更文件复印件;
5、注册证有效期内产品质量研究报告,包括:
(1)产品临床应用情况,用户投诉情况及采取的措施。
(2)医疗器械不良事件汇总研究评价报告,报告应对本产品上市后出现的可疑不良事件列表、说明在每一种情况下生产企业采取的处理与解决方案。对上述不良事件开展研究评价,阐明不良事件出现的原因并对其安全性、有效性的影响予以说明。
(3)在所有国家与地区的产品市场情况说明。
(4)产品监督抽验情况(如有)。
(5)如上市后出现了召回,应当说明召回原因、过程与处理结果。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
6、产品检验报告
如医疗器械强制性标准已经修订,应提供产品能够达到新要求的产品检验报告。产品检验报告可以是自检报告、委托验证报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械验证机构出具。
7、符合性申明
符合性申明应由法定代表人或负责人签字并加盖企业公章,并包括以下内容:
(1)注册人声明本产品符合《医疗器械注册管理措施》与相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单;
(2)所提交资料真实性的自我保证声明,并做出资料如有虚假承担法律责任的承诺;
8、如在原医疗器械注册证有效期内出现了涉及产品技术要求变更的,应当提交依据注册变更文件修改的产品技术要求一式两份。
9、申报资料时,不是法定代表人或负责人本人的,应当提交《授权委托书》。
10、提交申报资料。注册申报资料应有所提交资料目录,包括申报资料的一级与二级标题。每项二级标题对应的资料应单独编制页码。
注:
延续注册时,注册人应当按照《医疗器械说明书与标签管理规定》(国家食品药品监督管理总局令第6号)编写说明书与标签。如说明书与原经注册审查的医疗器械说明书有变化的,应当提供更改情况比较说明等相关文件。
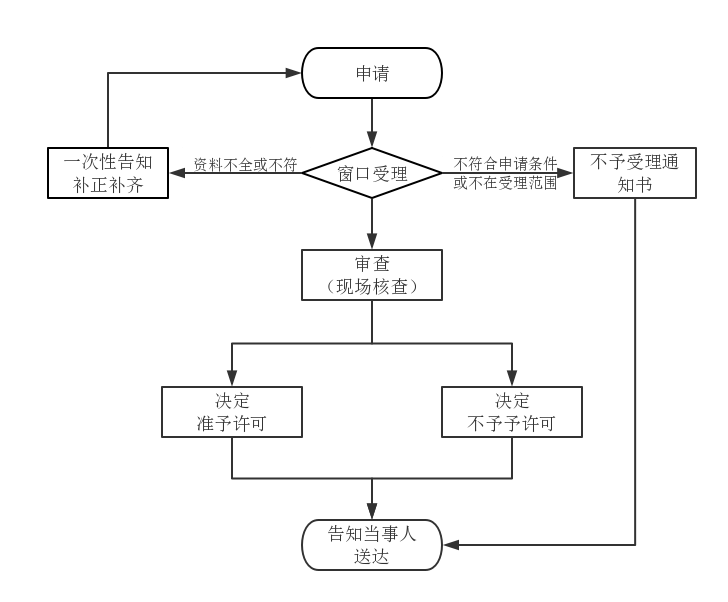
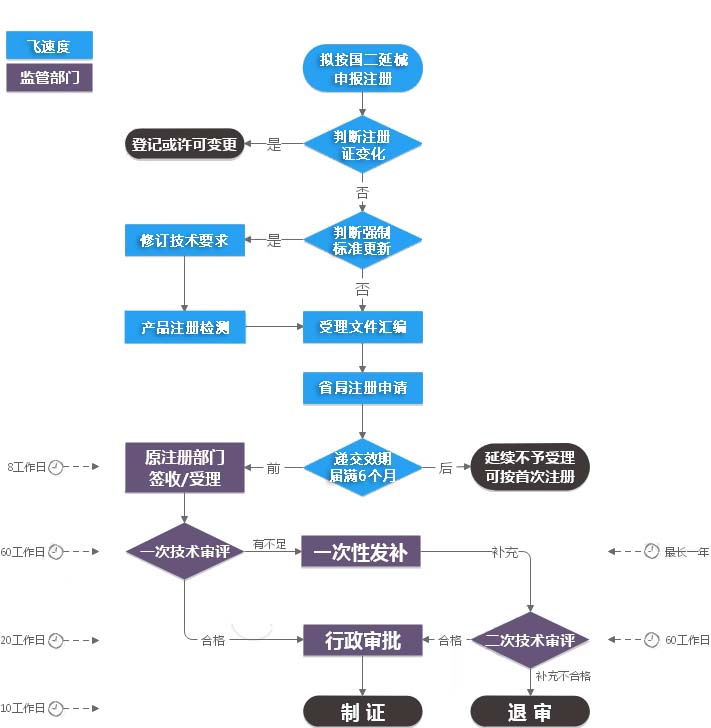
办理流程图
服务流程
官方收费
主管部门 管理类别 首次注册 注册变更
(许可事项变更)延续注册
(五年一次)相关文件 实施日期 省
局1 福建省 Ⅱ 5.77 2.42 2.39 闽发改服价函〔2021〕
361号2021/9/1 2 江西省 Ⅱ 3.8272 1.602 1.587 赣发改价管〔2023〕670号 2023/11/1 3 上海市 Ⅱ 2.3005.5 0.9628.5 0.9555 沪药监公告﹝2024﹞1号 2024年4月1日
(截止25年12月31日)4 海南省 Ⅱ 4.067 1.6856 1.6709 琼发改收费〔2021〕424号 2021/6/15 5 山东省 Ⅱ 4.6 1.92 1.9 鲁发改成本[2022]761号 2022/9/30
(截止25年10月7日)6 安徽省 Ⅱ 4.5045 1.4651 1.0395 皖发改价费函〔2024〕440号 2023/12/29
(截止26年1月1日)7 浙江省 Ⅱ 4.6011 1.5405 1.5288 浙药监械[2023]2号 2023/8/31 8 山西省 Ⅱ 1.26 0.48 0.48 晋发改收费发〔2023〕361号 2023/9/18 9 云南省 Ⅱ 0 0 0 / / 10 河北省 Ⅱ 0 0 0 / / 11 江苏省 Ⅱ 5.915
小微企业免征2.471 2.457 苏发改收管发[2019]91号 2019/2/13 12 宁夏 Ⅱ 0.75 0.325 0 宁发改价格(调控)函〔2025〕53号 2025/2/19 13 黑龙江 Ⅱ 3.312 1.403 1.38 黑发改价格〔2020〕712 号 2024/6/10 14 广东省 Ⅱ 5.726 2.394 2.38 粤发改价格函〔2019〕666号 2019/2/25 15 湖南省 Ⅱ 5.04 2.114 2.1 湘发改价费规〔2024〕416号 2024/6/10 16 四川省 Ⅱ 3.90 1.60 1.60 川发改价格〔2024〕585号 2024/12/1
(截止2029年12月1日)17 贵州省 Ⅱ 2.145 0.88 0.88 黔发改价格〔2024〕787号 2024/12/31 18 广西 Ⅱ 2.0187 1.264 0 桂发改价费函〔2024〕1327号 2024/6/11 19 辽宁省 Ⅱ 5 2.1 2.1 辽药监告〔2023〕70号 2023/7/20 20 吉林省 Ⅱ 0 0 0 吉政发〔2020〕4号 2020/2/8 21 湖北省 Ⅱ 0 0 0 / / 22 河南省 Ⅱ 0 0 0 / / 23 重庆市 Ⅱ 0 0 0 渝府办发〔2019〕56号 2019/5/15 24 甘肃省 Ⅱ 0 0 0 / / 25 新疆 Ⅱ 0.28 0.24 0.12 新发改收费〔2024〕158 号 2024/4/18 26 内蒙古 Ⅱ 0 0 0 内发改费字〔2019〕773号 2019/9/17 27 北京市 Ⅱ 0 0 0 京发改[2019]569号 2019/4/25 28 天津市 Ⅱ 0 0 0 津党发[2018]39号 2019/1/4 29 陕西省 Ⅱ 0 0 0 陕财税[2019]26号 2020/1/10 更新时间:2025年4月25日
单位:万元
提交留言