第三类医疗器械首次注册
服务价:¥面议

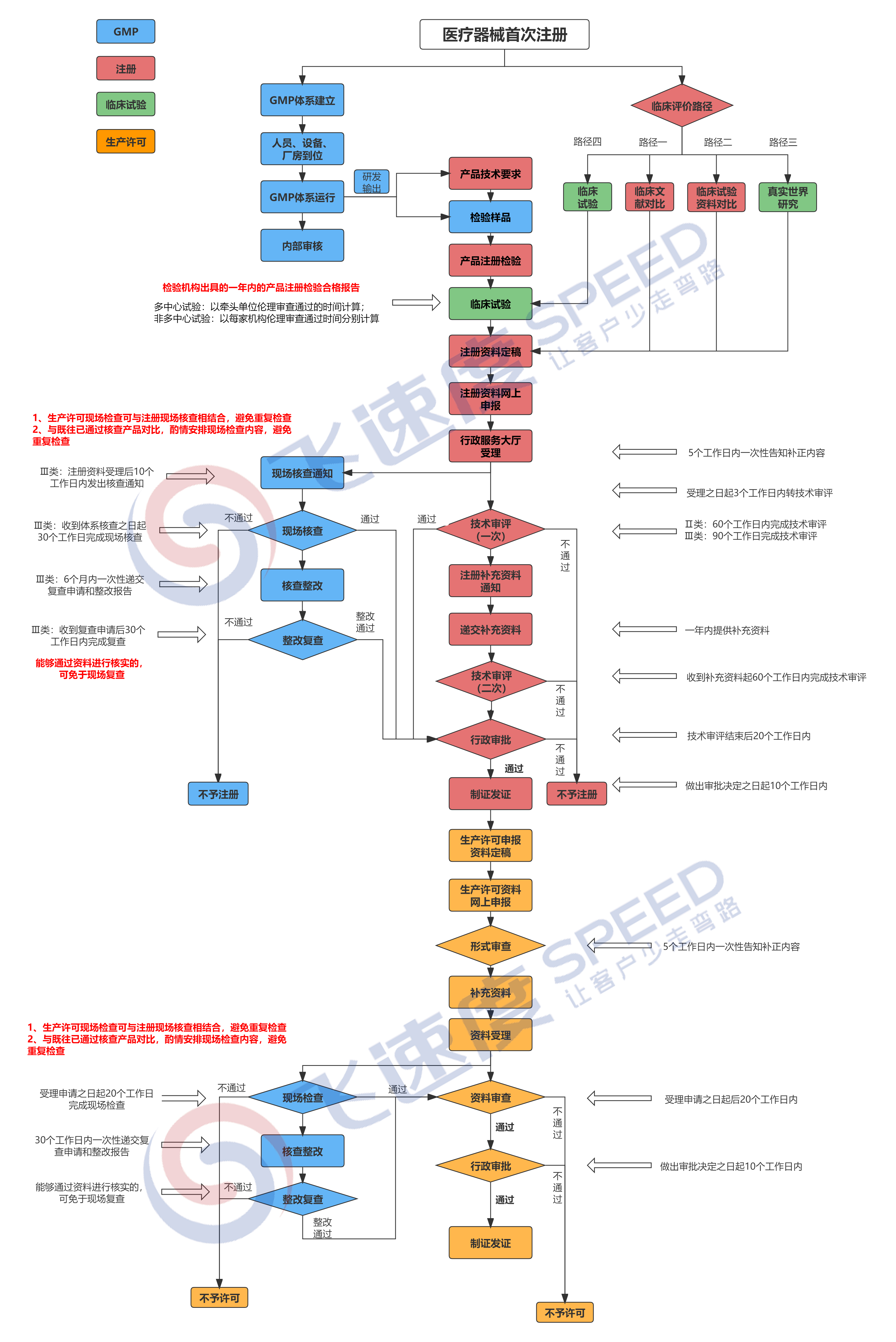
国产三类医疗器械首次注册是企业将高风险医疗器械产品推向市场的根本准入环节,其申报过程因涉及严格的安全性、有效性验证及复杂的法规要求,被公认为医疗器械行业合规门槛最高、技术难度最大的审批事项。按照《医疗器械监督管理条例》,三类医疗器械需通过临床试验、技术审评及质量管理体系核查等多维度审查,且申报材料需涵盖产品技术要求、风险研究、临床评价等十余类专业文件,任何资料缺失或逻辑矛盾均可能结果审批延期甚至注册失败。面对平均12-24个月的申报周期、动辄数十万的成本投入以及跨地区沟通协调等现实挑战,飞速度凭借深度政策研究能力、药监系统资源网络及专业注册团队,为企业提供全链条代办服务,尤其针对异地申报企业存在的“政策盲区”“流程断点”“审评沟通壁垒”等痛点,通过预审优化申报策略、前置避免合规风险,助力企业突破地域与专业限制,实现注册效率与成功率双提升。
三类医疗器械注册申报资料及具体要求
1、医疗器械注册申请表:医疗器械注册申请表是注册申请的重要资料之一,表内各项应符合填写说明要求。
2、医疗器械生产企业资格证明。
(1)生产企业许可证副本及营业执照副本的复印件,并加盖证书所属企业公章;
(2)所申请产品应当在生产企业许可证核定的生产范围之内;
(3)在有效期内。
3、产品技术报告:应加盖生产企业公章。
4、安全风险研究报告:应加盖生产企业公章。
5、适用的产品标准及说明:
(1)标准文本,应加盖生产企业公章;
(2)编制说明(适用于注册产品标准);
(3)申报产品应包括在产品标准范围内;
(4)按照基于国家标准、行业标准作为产品的适用标准的:
①生产企业应当提供所申请产品符合国家标准、行业标准的声明,并加盖生产企业公章;
②生产企业承担产品上市后的质量责任的声明,并加盖生产企业公章;
③生产企业密切相关产品型号、规格划分的说明,并加盖生产企业公章。
6、产品性能自测报告:
(1)应当有主检人或主检负责人、审核人签字,并加盖生产企业公章;
(2)执行国家标准、行业标准的,生产企业应当补充自定的出厂检测项目,并加盖生产企业公章。
7、医疗器械检测机构出具的产品注册检测报告:
(1)所检产品的规格型号应在本次注册申请范围内;
(2)检测类型应为注册检测或全性能国家监督抽查检测;
(3)原件;
(4)在有效期内(执行《措施》附件3第7条)。
注:执行《措施》第十一条、第十二条、第十三条的规定的,生产企业应当提供相应的说明文件,并加盖生产企业公章。
8、医疗器械临床试验资料:
(1)生产企业应当在两家以上(含两家)“医疗器械临床试验机构”开展临床试验;
(2)其临床试验资料中应当包括临床试验合同、临床试验方案、临床试验报告:
①临床试验合同应有承担临床试验的医疗机构及实施者签字并盖章;
②临床试验方案应有伦理委员会、承担临床试验的医疗机构及实施者盖章;
③临床试验报告应有临床试验负责人及临床试验人员签字并由试验主管部门盖章确认。
9、医疗器械说明书:应提供说明书并加盖生产企业公章;省略说明书的,应由生产企业出具说明文件,并加盖生产企业公章。
10、产品生产质量体系考核(认证)的有效证明文件——按照对不同产品的要求,提供相应的质量体系考核报告。
(1)省、自治区、直辖市药监管理部门签章;若为医疗器械质量体系认证证书可以提供复印件,但应加盖证书所属企业公章;
(2)在有效期内;
(3)体系涵盖申报产品。
11、所提交材料真实性的自我保证声明:
(1)所提交材料的清单;
(2)生产企业承担法律责任的承诺;
(3)加盖生产企业公章。
12、申请资料(重点是临床试验报告)与样品生产过程的真实性核查报告。
各省(区、市)食品药品监督管理部门在质量管理体系考核过程中,要对生产企业拟提交的第三类医疗器械首次注册申请资料(重点是临床试验报告)与样品生产过程的真实性组织核查。生产企业在指出体系考核申请时,应当同时递交相关资料。对承担临床试验的医疗机构不在生产企业所在省(区、市)辖区内的,生产企业所在地的省(区、市)食品药品监督管理部门可以委托承担临床试验的医疗机构所在地的省(区、市)食品药品监督管理部门组织核查,并出具核查意见。国家食品药品监督管理局按照需要对第三类医疗器械首次注册申请资料真实性的核查情况开展抽查。
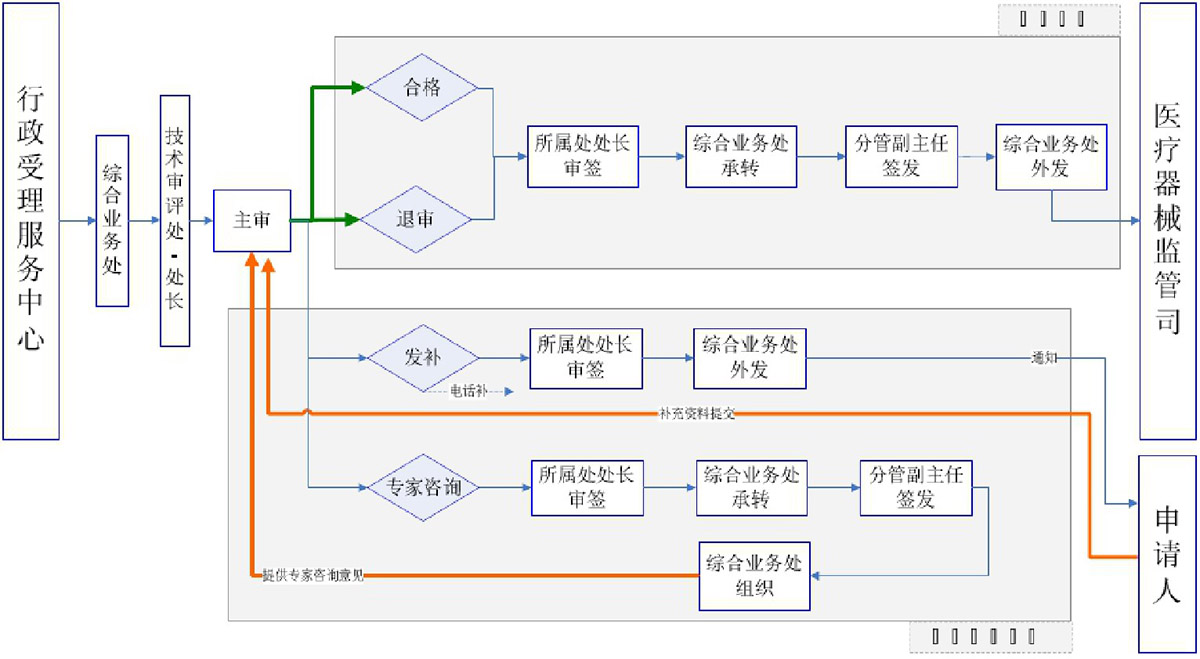
三类医疗器械产品注册审评业务流程
法定审批时限
1.《医疗器械监督管理条例》第十八条 第一款受理注册申请的药品监督管理部门应当自收到审评意见之日起20个工作日内作出决定。
2.《体外诊断试剂注册与备案管理措施》(市场监管总局令第48号)第九十二条 体外诊断试剂注册技术审评时限,按照以下 规定执行:(一)第二类体外诊断试剂注册申请、变更注册申请、 延续注册申请的技术审评时限为 60 日,申请资料补正后的技 术审评时限为 60 日;
(二)第三类体外诊断试剂注册申请、变更注册申请、 延续注册申请的技术审评时限为 90 日,申请资料补正后的技 术审评时限为 60 日。
3.《医疗器械注册与备案管理措施》(市场监管总局令第47号)第九十二条 医疗器械注册技术审评时限,按照以下规定执行:(一)医疗器械临床试验申请的技术审评时限为60日,申请资料补正后的技术审评时限为40日;
(二)第二类医疗器械注册申请、变更注册申请、延续注册申请的技术审评时限为60日,申请资料补正后的技术审评时限为60日;
(三)第三类医疗器械注册申请、变更注册申请、延续注册申请的技术审评时限为90日,申请资料补正后的技术审评时限为60日。
部分医疗器械注册客户名单
客户咨询解答
1、如何准备临床评价资料?
答:行政相对人可参考《国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告》(2021年第73号)准备临床评价资料。
2、三类有源医疗器械,产品技术要求的附录要写EMC的相关内容吗?附录只需写一句电磁兼容的分组分类就行了吧?
答:二类有源是要写的,技术要求不需要的,写一条符合0505有专标写上专标条款即可。3、三类产品注册体系核查申报资料,从哪个网站上传?是提交给省局,还是提交给国家局?
答:省局
服务流程
官方收费
主管部门 管理类别 首次注册 变更注册
(许可事项变更)延续注册
(五年一次)临床试验申请费
(高风险医疗器械)相关文件 实施日期 国家局 境内 Ⅲ 15.36 5.04 4.08 4.32 局令15年53号 2015/5/27 单位:万元
提交留言