进口第二类医疗器械首次注册
服务价:¥面议

进口第二类医疗器械首次注册是境外企业将中等风险医疗器械产品合法引入中国市场的根本准入程序。该注册由国家药品监督管理局(NMPA)依据《医疗器械监督管理条例》实施严格审查,旨在通过科学评估确保产品安全性、有效性及全生命周期质量可控性。作为连接国际医疗器械市场与中国法规体系的桥梁,该程序要求境外申请人必须指定中国境内企业法人作为代理人,并提交符合中国国家标准(如GB系列)及《医疗器械生产质量管理规范》的技术文件。注册通过后发表的《医疗器械注册证》不仅是产品合法流通的凭证,更标志着企业完成从全球供应链到中国本土化监管体系的合规衔接。
进口第二类医疗器械注册证(首次注册)申报文件
1、生产者的合法生产资格的证明文件
(1)由原产国政府部门批准其可以从事医疗器械生产与经营的证明文件(相当于我国的工商营业执照或生产许可证。);
(2)该证明文件可以是复印件,但须经原出证机关签章或者经当地公证机构公证。
2、申请者的资格证明文件
(1)申请者的营业执照;
(2)生产者给予的代理注册的委托书。
3、原产国(地区)政府批准或认可的该产品作为医疗器械进入该国市场的证明文件
4、注册产品标准执行医疗器械标准管理措施
5、产品使用说明书
6、药监总局认可的医疗器械质量检验机构近一年内出具的型式试验报告
7、医疗器械临床试验报告,报告提供方式执行《医疗器械注册临床报告分项规定》。临床试验按《医疗器械产品临床试验管理措施》开展。
8、生产者出具的产品质量保证书,承诺在中国注册销售的产品与在原产国(地区)上市的一致,产品质量完全一致。
9、在中国指定售后服务机构的委托书、被委托机构的承诺书及营业执照。
10、所提交材料真实性的自我保证声明。
境外申请人应当提交资料
1、境外申请人注册地或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件、企业资格证明文件。
2、境外申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3、境外申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
进口医疗器械注册客户咨询问题解答
1、进口医疗器械国外生产,国内代理人是不是不用办理生产许可证?在国内销售要办理经营许可证吗?
答:是的,不用办理生产许可,因为产品在国外生产,但需要到国家药监局办理医疗器械进口注册证。国外公司制造的进口医疗器械在中国销售,销售商的资质应是“工商营业执照”与“医疗器械经营许可证”,产品是几类的,对应办理一致类别的经营许可证。
2、如何准备临床评价资料?
答: 行政相对人可参考《国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告》(2021年第73号)准备临床评价资料。
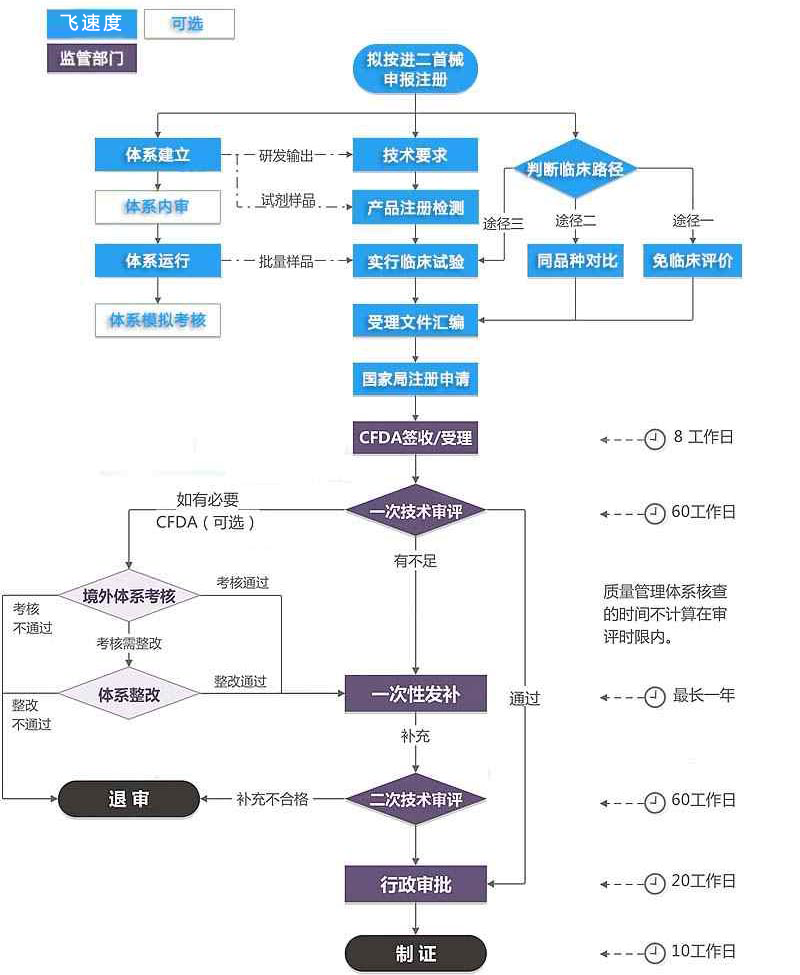
服务流程
官方收费
主管部门 管理类别 首次注册
(万元)临床试验申请费
(高风险医疗器械)相关文件 实施日期 国
家
局境
外Ⅱ 21.09 / 国家局2015年53号 2015/5/27 法定审批时限
1.《医疗器械监督管理条例》第十八条 受理注册申请的药品监督管理部门应当自收到审评意见之日起20个工作日内作出决定。
2.《体外诊断试剂注册与备案管理措施》(市场监管总局令第48号)第九十二条 体外诊断试剂注册技术审评时限,按照以下规定执行:(一)第二类体外诊断试剂注册申请、变更注册申请、延续注册申请的技术审评时限为 60 日,申请资料补正后的技术审评时限为 60 日;
(二)第三类体外诊断试剂注册申请、变更注册申请、延续注册申请的技术审评时限为 90 日,申请资料补正后的技术审评时限为 60 日。
3.《医疗器械注册与备案管理措施》(市场监管总局令第47号)第九十二条 医疗器械注册技术审评时限,按照以下规定执行:(一)医疗器械临床试验申请的技术审评时限为60日,申请资料补正后的技术审评时限为40日;
(二)第二类医疗器械注册申请、变更注册申请、延续注册申请的技术审评时限为60日,申请资料补正后的技术审评时限为60日;
(三)第三类医疗器械注册申请、变更注册申请、延续注册申请的技术审评时限为90日,申请资料补正后的技术审评时限为60日。
提交留言