进口第三类医疗器械首次注册
服务价:¥面议

进口第三类医疗器械首次注册是境外企业将高风险医疗产品合法引入中国市场的根本准入程序,由国家药品监督管理局(NMPA)依据《医疗器械监督管理条例》实施全链条监管。作为中国医疗器械分类中的最高风险等级,该类产品需通过包括技术审评、质量管理体系核查及临床评价(如适用)等多维度科学评估,确保其安全性、有效性及全生命周期质量可控性。注册申请人须通过中国境内企业法人作为代理人提交申请,并承诺产品符合GB系列国家标准及《医疗器械生产质量管理规范》。成功获批的《医疗器械注册证》不仅是产品合法流通的凭证(有效期5年),更是企业完成国际标准与中国本土化监管体系衔接的标志。
进口三类医疗器械注册证申请条件
申请人应为境外生产企业(营利法人;非营利法人;非法人组织),且该医疗器械已在申请人注册地或者生产地址所在国家(地区)已获准上市销售。
申请注册的产品符合安全、有效、质量可控要求,注册申请人具有保证医疗器械安全、有效的质量管理能力。
申请不获得通过的情形有哪些?
1、申请人对拟上市销售医疗器械的安全性、有效性开展的研究及其结果无法证明产品安全、有效的;
2、注册申报资料虚假的;
3、注册申报资料内容混乱、矛盾的;
4、注册申报资料的内容与申报项目显著不符的;
5、不予注册的其他情形。
境外申请人应当提交资料
1、境外申请人注册地或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件、企业资格证明文件。
2、境外申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3、境外申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
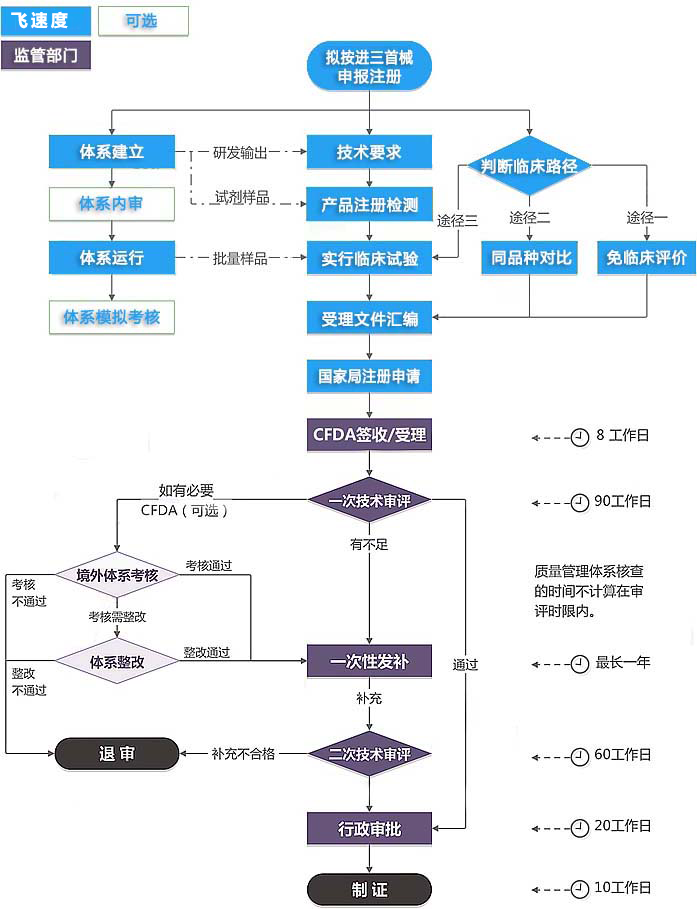
服务流程
官费收费
主管部门 管理类别 首次注册 注册变更
(许可事项变更)延续注册
(五年一次)临床试验申请费
(高风险医疗器械)相关文件 实施日期 国家局 境外 Ⅲ 30.88 5.04 4.08 4.32 国家局2015年53号 2015/5/27 单位:万元法定审批时限
1.《体外诊断试剂注册与备案管理措施》(市场监管总局令第48号)第九十二条 体外诊断试剂注册技术审评时限,按照以下规定执行:
(一)第二类体外诊断试剂注册申请、变更注册申请、延续注册申请的技术审评时限为60日,申请资料补正后的技术审评时限为60日;
(二)第三类体外诊断试剂注册申请、变更注册申请、延续注册申请的技术审评时限为90日,申请资料补正后的技术审评时限为60日。
2.《医疗器械注册与备案管理措施》(市场监管总局令第47号)第九十二条 医疗器械注册技术审评时限,按照以下规定执行:
(一)医疗器械临床试验申请的技术审评时限为60日,申请资料补正后的技术审评时限为40日;
(二)第二类医疗器械注册申请、变更注册申请、延续注册申请的技术审评时限为60日,申请资料补正后的技术审评时限为60日;
(三)第三类医疗器械注册申请、变更注册申请、延续注册申请的技术审评时限为90日,申请资料补正后的技术审评时限为60日。
3.《医疗器械监督管理条例》第十八条 受理注册申请的药品监督管理部门应当自收到审评意见之日起20个工作日内作出决定。
提交留言