药物/医疗器械临床试验机构备案
服务价:¥面议

药物/医疗器械临床试验机构备案是我国深化医药审评审批制度改革的重要举措,旨在通过备案制动态管理释放优质临床资源,构建科学化、规范化的临床试验生态体系。该制度以风险分级管控为根本,要求机构在备案前需对自身技术水平、设施条件及伦理审查能力开展全面评估,确保其符合《药物临床试验质量管理规范》(GCP)或《医疗器械临床试验质量管理规范》要求。例如,承担高风险第三类医疗器械或新药Ⅰ期临床试验的机构,必须为三级甲等医疗机构或省级以上疾病预防控制机构,且主要研究者需具备高级职称并参与过至少3项同类试验。
备案机制通过国家统一信息平台实现透明化管理,备案机构的基本信息、专业范围及变更情况均向社会公开,接受实时监督。同时,备案并非一劳永逸,机构需每年提交工作总结,并在专业增减、地址变更时动态更新备案信息,确保技术能力与监管要求同步迭代。这一制度既打破了传统资质认定的行政壁垒,又通过全生命周期责任追溯(如临床试验数据真实性、受试者权益保护)强化机构主体责任,为医药创新提供高质量的临床研究支撑。
药物机构备案条件
(一)具有医疗机构执业许可证,具有二级甲等以上资质,试验场地应当符合所在区域卫生健康主管部门对院区(场地)管理规定。开展以患者为受试者的药物临床试验的专业应当与医疗机构执业许可的诊疗科目相一致。开展健康受试者的Ⅰ期药物临床试验、生物等效性试验应当为Ⅰ期临床试验研究室专业;
(二)具有与开展药物临床试验相适应的诊疗技术能力;
(三)具有与药物临床试验相适应的独立的工作场所、独立的临床试验用药房、独立的资料室,以及必要的设备设施;
(四)具有掌握药物临床试验技术与相关法规,能承担药物临床试验的某学说学派;其中主要研究者应当具有高级职称并参加过3个以上药物临床试验;
(五)开展药物临床试验的专业具有与承担药物临床试验相适应的床位数、门急诊量;
(六)具有急危重病症抢救的设施设备、人员与处置能力;
(七)具有承担药物临床试验组织管理的专门部门;
(八)具有与开展药物临床试验相适应的医技科室,委托医学检测的承担机构应当具备相应资质;
(九)具有负责药物临床试验伦理审查的伦理委员会;
(十)具有药物临床试验管理制度与标准操作规程;
(十一)具有防范与处理药物临床试验中突发事件的管理机制与措施;
(十二)卫生健康主管部门规定的医务人员管理、财务管理等其他条件。
药物临床试验机构为疾病预防控制机构的,应当为省级以上疾病预防控制机构,不要求本条前款第一项、第五项、第六项条件。
医疗器械机构备案条件
(一)具有医疗机构执业资格;
(二)具有二级甲等以上资质;
(三)承担需开展临床试验审批的第三类医疗器械临床试验的,应为三级甲等医疗机构;
(四)具有医疗器械临床试验管理部门,配备适宜的管理人员、办公条件,并具有对医疗器械临床试验的组织管理与质量控制能力;
(五)具有符合医疗器械临床试验质量管理规范要求的伦理委员会;
(六)具有医疗器械临床试验管理制度与标准操作规程;
(七)具有与开展相关医疗器械临床试验相适应的诊疗科目,且应与医疗机构执业许可诊疗科目一致;
(八)具有能够承担医疗器械临床试验的人员,医疗器械临床试验主要研究者应当具有高级职称,其中开展创新医疗器械产品或需开展临床试验审批的第三类医疗器械产品临床试验的主要研究者应参加过3个以上医疗器械或药物临床试验;
(九)已开展相关医疗业务,能够满足医疗器械临床试验所需的受试人群要求等;
(十)具有防范与处理医疗器械临床试验中突发事件与严重不良事件的应急机制与处置能力;
(十一)国家食品药品监督管理总局、国家卫生与计划生育委员会规定的其他条件。
其他承担体外诊断试剂临床试验的血液中心与中心血站、设区的市级以上疾病预防控制机构、戒毒中心等非医疗机构开展按医疗器械管理的体外诊断试剂临床试验,其应当具备以下条件:
(一)具有相应业务主管部门发放的机构资质证明文件;
(二)具有体外诊断试剂临床试验的管理部门,配备相应人员、办公条件,并具有对体外诊断试剂临床试验的组织管理与质量控制能力;
(三)能够开展伦理审查工作;
(四)具有体外诊断试剂临床试验管理制度与标准操作规程;
(五)具有与开展体外诊断试剂临床试验相适应的诊疗科目,且应与本机构业务范围一致;
(六)具有能够承担临床试验的人员,临床试验主要研究者应当具有高级职称;
(七)已开展相关业务,能够满足体外诊断试剂临床试验所需的受试人群要求等;
(八)具有防范与处理医疗器械临床试验中突发事件与严重不良事件的应急机制与处置能力;
(九)国家食品药品监督管理总局、国家卫生与计划生育委员会规定的其他条件。
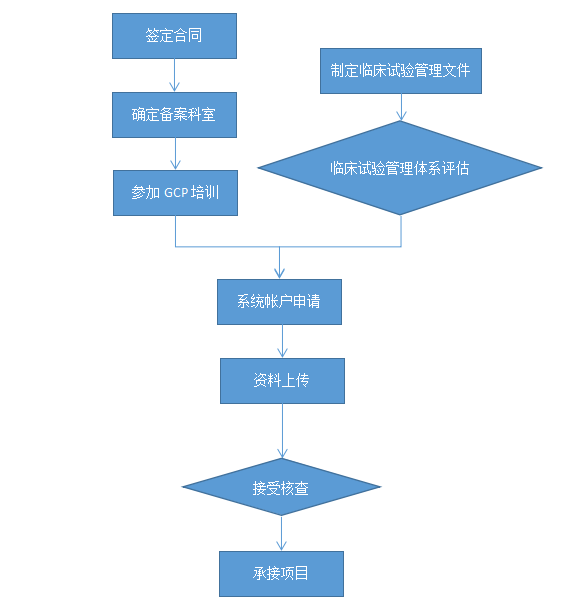
服务流程
官方收费
办理医疗器械/药物临床试验机构备案,官方不收取费用。
提交留言