医疗器械分类界定
服务价:¥面议

医疗器械分类界定是我国对医疗产品实施精准化、科学化监管的根本制度,其基于风险分级原则,通过多维度的技术指标与临床应用场景,构建了覆盖全生命周期的管理体系。依据《医疗器械分类规则》,医疗器械的界定需综合考量结构特征(有源/无源器械)、使用形式(侵入性、接触部位、使用时长)及临床影响(对人体损伤概率与医疗效果关联度)三大根本维度。例如,无源器械按照是否接触人体分为敷料、植入物等类别,而有源器械则按失控风险等级(如轻微至严重损伤)细化管理要求。
分类体系将医疗器械分为第一类(低风险)、第二类(中风险)与第三类(高风险),例如创可贴属于一类,血压计为二类,心脏支架则归为三类。界定过程中,若产品适用多类别,则遵循“风险就高”原则,并动态纳入新技术产品(如可吸收材料自动归为三类)。这一框架不仅为注册审批、生产许可提供依据,更通过分类目录动态更新机制,确保监管与医疗技术发展同步。
医疗器械分类界定适用范围
1、新研制的尚未列入《分类目录》或分类界定通知等文件的医疗器械,即未在我国境内上市的全新产品;
2、与已上市产品相比,产品的技术原理、结构组成、使用部位或技术特点、预期目的等出现了影响产品分类的实质性变化,按照《分类目录》或分类界定通知等文件难以确定管理类别的医疗器械;
3、在技术审评中发现产品未列入《分类目录》等文件中,或者未经分类界定信息系统告知分类界定结果的;
4、日常监管、稽查、投诉举报中涉及产品类别确认的;
医疗器械分类界定的作用
1、产品中文名称、预期用途、结构特征、使用方法等的法规符合性审核;
2、确认是否属于医疗器械管理;
3、确认是否满足医疗器械注册要求;
4、确认是否满足中国上市要求;
5、确认法规符合性要求;
6、质量体系现场检查;
7、弄清楚医疗器械的管理类别及注册要求。
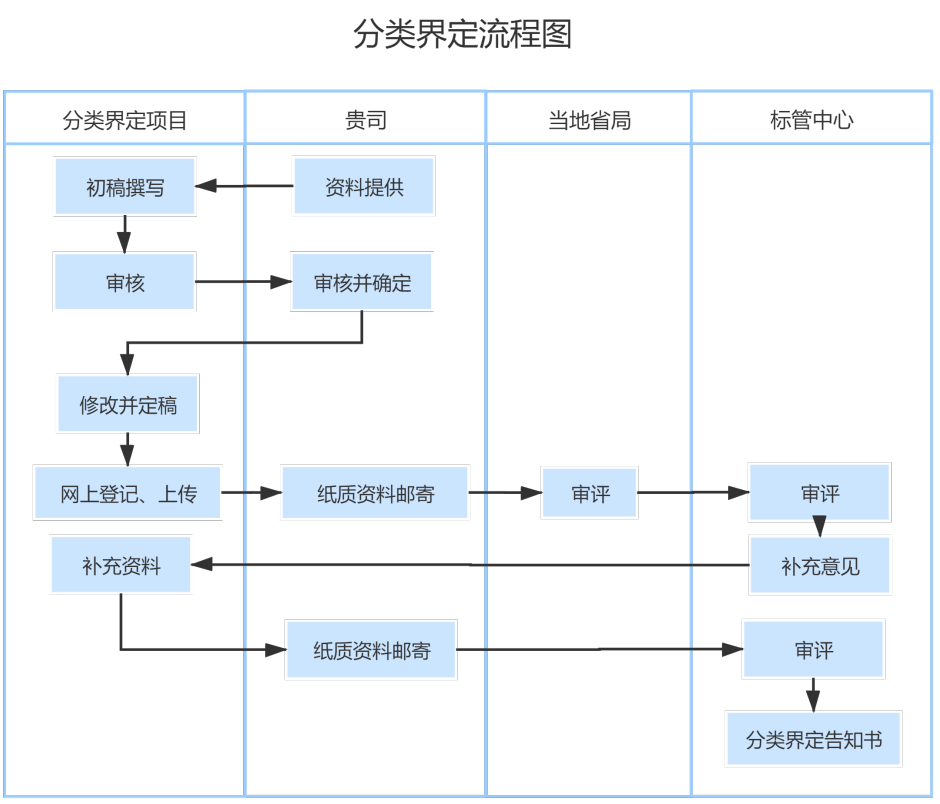
医疗器械分类界定工作流程
1、申请方式
在递交书面申报材料前,申请企业通过网站进入“医疗器械标准管理信息系统”页面,点击“ 分类界定新用户注册(企业) ”注册后填写《分类界定申请表》,并上传其他申请材料。
在线打印《医疗器械分类界定申请表》,连同其他申请材料(应与网上上传的资料完全一致)加盖申请企业骑缝章,邮寄送至相关单位。国内医疗器械产品的相关材料寄至申请企业所在省食品药品监督管理局,进口及港、澳、台产品的相关材料寄送至国家食品药品监督管理总局医疗器械标准管理中心。
2、申请材料目录
(1)医疗器械分类界定申请表;
(2)产品照片与/或产品结构图;
(3)产品技术要求及产品说明书(样稿);
(4)进口上市证明材料(如有);
(5)资料真实性自我保证声明;
(6)其他与产品分类界定密切相关的材料。其中对于尚未列入《分类目录》等文件的新研制产品,至少还应当提交:
①与国内外已上市相关产品、《分类目录》或分类界定通知文件中相关产品的研究及比较,并说明符合新研制尚未列入分类目录产品的判定依据;
②根本刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述(如有);
③产品的创新内容;
④信息或者专利检索机构出具的查新报告。
所有申请材料应当使用中文。按照外文资料翻译的,应当同时提供原文。
3、申请状态与结果查询
各省级食品药品监督管理部门、各级医疗器械技术审评部门与申请人登陆“医疗器械分类界定信息系统”,在“操作栏”中点击“查看流程图”,即可查询申请状态与结果。
医疗器械分类界定流程图
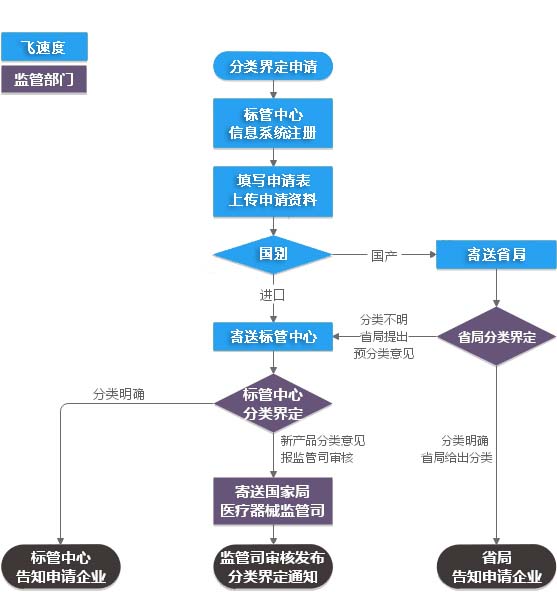
服务流程
官方收费
申请医疗器械分类界定,官方不收取申请费用。飞速度代理申请分类界定,将收取部分服务费。
医疗器械分类界定服务周期
1.受理前资料准备
签署合作合同后,资料准备时间为3个工作日。
递交药监管理部门约1个工作日。
2.申报时长
省局、标管中心、国家局器械司分别消耗20工作日。
3.处理时间
短的20工作日能有结果,长的至少60工作日或以上。
提交留言