第一类医疗器械生产备案
服务价:¥面议

第一类医疗器械生产备案是中国对低风险医疗器械生产活动实施分类监管的基础性制度,依据《医疗器械监督管理条例》(国务院令第739号)及配套规章,按照基于“事前备案+事后监管”模式,实现风险可控前提下的高效准入。该备案由生产企业向所在地设区的市级药品监督管理部门提交申请,通过形式审查即时完成备案,备案凭证编号遵循“XX食药监械生产备XXXXXXXX号”规则(如“京食药监械生产备20250001号”),体现属地管理与全国统一编码的双重特征。
备案制度以“放管服”改革为导向,通过境内代理人机制衔接国际供应链(进口产品需指定境内法人代理),同时要求生产场地、设备及质量体系符合《医疗器械生产质量管理规范》。备案完成后,药监部门将在3个月内开展现场检查,对不符合规范的企业采取限期整改或取消备案等监管措施,形成“备案-检查-追溯”闭环。2024年分类目录动态调整后,企业需主动开展备案产品合规性自查,确保与最新目录匹配,彰显分类监管的科学性与时效性。
企业具备条件
1、有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;
2、有对生产的医疗器械开展质量检验的机构或者专职检验人员以及检验设备;
3、有保证医疗器械质量的管理制度;
4、有与生产的医疗器械相适应的售后服务能力;
5、产品研制、生产工艺文件规定的要求。
医疗器械生产备案/许可流程及要求
注册登记流程 资料要求及确认工作 客户配合工作内容 公司名称预先核准 1.全体投资人签署的《企业名称预先核准申请书》
2.全体投资人签署的《指定代表或者共同委托代理人的证明》及指定代表或者共同委托代理人的身份证件复印件全体投资人签署对应文件 确定生产许可范围 确认需要办理生产许可的品种(第Ⅰ类医疗器械生产企业需要开展备案) 提供拟生产的医疗器械品种 申请前准备工作 人员及培训 1.法定代表人、企业负责人的基本情况及资质证明
2.企业的生产、技术、质量部门负责人简历,学历与职称证书的复印件;相关专业技术人员、技术工人登记表、证书复印件,并标注清楚所在部门及岗位;高、中、初级技术人员的比例情况表;内审员证书复印件。提供相关人员身份证及证书等 场地及设施 1.生产场地证明文件。
2.主要生产设备及检验仪器清单
3.拟生产无菌医疗器械或对生产环境有空气净化要求的体外诊断试剂的,需提供洁净室的合格检测报告。提供生产场地及设备的证明文件 生产产品及生产工艺 1.拟生产产品范围、品种与相关产品简介
2.拟生产产品的工艺流程图,并注明主要控制项目与控制点提供相应证明文件 质量管理体系文件 生产质量管理规范文件目录 提供质量管理体系文件 自查自评 企业应按照相关标准开展自查 配合自查自评 企业身份识别系统申请 企业身份识别系统办理申请表
企业名称核准通知书复印件提供相关识别信息并盖章 准备电子及纸质申请材料 在线申请,并打印医疗器械生产企业许可证申请表(如适用),及其它申请材料 核对及签章 生产许可受理,资料审查及现场检查 配合资料补正及现场核查 配合现场核查 生产许可公示及发证 获得生产许可证书 获得生产许可证书
人员及场地要求
1、人员要求:
(1)法定代表人,学历不限(建议有学历的情况下,法人可兼任企业负责人;无学历,不建议兼任。);
(2)企业负责人,如由法人兼任,可以无学历;若不是法人,需中专以上学历,不限专业;不兼任需提供个人简历;
(3)技术负责人,中专以上学历,医疗器械相关专业毕业;
(4)生产负责人,中专以上学历,医疗器械相关专业毕业;
(5)质量负责人,中专以上学历,医疗器械相关专业毕业;
(6)检验员(至少2名),中专以上学历,医疗器械相关专业毕业;
(7)采购人员,无学历与专业要求;
(8)销售人员,无学历与专业要求;
(9)人事人员,无学历与专业要求;
(10)办公室,无学历与专业要求;
(11)仓库保管,无学历与专业要求;
(12)设备管理,无学历与专业要求;
注:
(1)医疗器械相关专业:医疗器械、生物医学工程、机械、电子、医学、生物工程、高分子物理与化学、护理学、康复、检验学、管理、计算机等专业;
(2)生产备案申报资料对7-12人员无要求,是啥学历就写啥,无学历可不写,有的写上。7-12的人员按照公司实际岗位情况摆设。
2、场地要求:
场地性质为非住宅。生产类常见办公区域与生产区域不在同个片区,因此对面积无具体要求,符合产品生产范围与要求就行。
医疗器械生产备案/许可办理整体流程图
官方备案审批流程程序
1、企业提交申请材料;
2、审核材料。当场对备案材料完整性开展核对,符合规定条件的,予以备案。对备案材料不齐全或者不符合规定形式的,应当一次性告知需要补正的全部材料。对不予备案的,应当当场告知申请人并说明理由;
3、科长复核;
4、主管局长签批;
5、发放备案凭证;
6、网上公示。
客户疑难解答
1、请问一类产品备案完后,是不是立马就可以开展生产备案?有没有哪个地方可以同时申请?生产备案的其中一个资料就是产品备案凭证,那理论上产品备案没搞完,生产备案就没措施开始。
答:正常先后顺序是产品备案后办理生产备案,也有同时申请的情况,但各地实操略有差别。法规弄清楚指出一类生产备案在市局办理,因此还是建议与所在地市直接沟通。郑州目前把市区内一类审核下放给各区局,荥阳隶属于郑州市,荥阳的生产企业需要提交资料给市局。
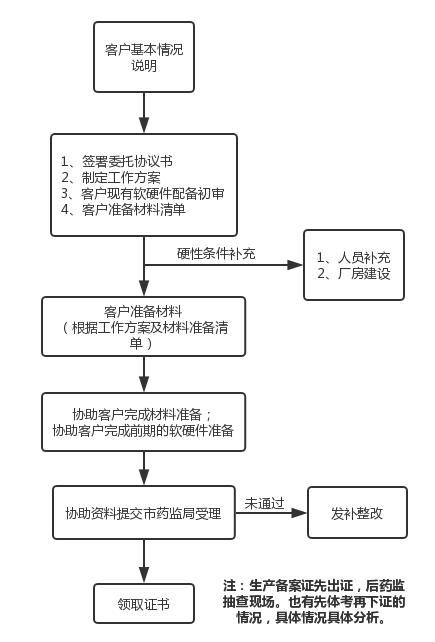
服务流程
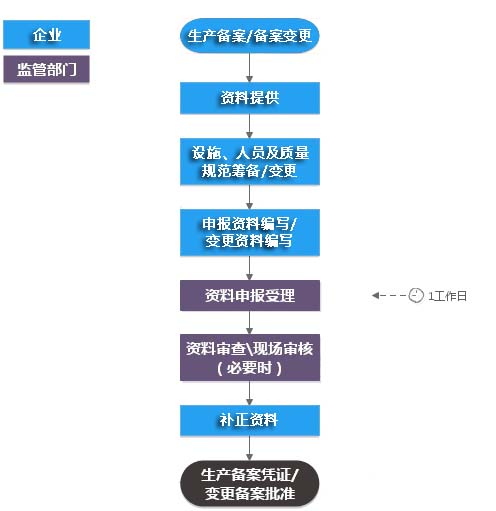
医疗器械生产备案/备案凭证变更(不含现场)代办流程
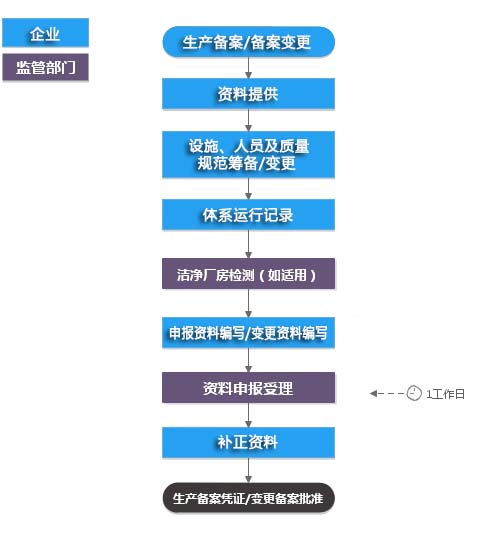
医疗器械生产备案/备案凭证变更(含现场)服务流程
官方收费
办理一类医疗器械生产备案/备案凭证变更申请,官方不收取费用。
提交留言