第三类医疗器械注册延续
服务价:¥面议

第三类医疗器械注册延续是保障高风险医疗器械全生命周期安全性与有效性的根本监管机制,其以动态风险管控为内核,通过严格的时间节点与技术审查,确保产品在技术迭代、标准升级及临床应用中持续合规。依据《医疗器械监督管理条例》,注册人需在证书有效期届满6个月前向原注册部门提交延续申请,逾期未申请或未通过审查将结果注册证失效,产品退出市场。
延续注册并非单纯行政程序的重复,而是监管部门对产品技术合规性(如是否符合新版强制性标准)、质量管理体系有效性(如生产条件与风险控制能力)及附条件审批事项完成度(如补充临床试验或上市后研究)的系统性再评估。例如,若医疗器械未能适配修订后的国家标准或未履行注册证载明的义务(如罕见病治疗器械的补充数据提交),监管部门将直接否决延续申请。此外,新注册证有效期的起算方式与审批时效紧密关联:若在原证有效期内获批,新证自到期次日起生效;若超期获批,则以批准日为起点,既体现监管弹性,又强化企业合规意识。这一机制通过倒逼企业形成持续改进体系,推动医疗器械技术与监管要求的同步发展,筑牢高风险医疗产品的市场准入防线。
三类医疗器械注册证延注申报资料
1、申请表
2、证明性文件
注册人应当提交企业营业执照的副本复印件与组织机构代码证复印件。
3、关于产品没有变化的声明
注册人提供产品没有变化的声明。
4、原医疗器械注册证及其附件的复印件、历次医疗器械注册变更文件复印件。
5、注册证有效期内产品研究报告
(1)产品临床应用情况,用户投诉情况及采取的措施。
(2)医疗器械不良事件汇总研究评价报告,报告应对本产品上市后出现的可疑不良事件列表、说明在每一种情况下生产企业采取的处理与解决方案。对上述不良事件开展研究评价,阐明不良事件出现的原因并对其安全性、有效性的影响予以说明。
(3)产品市场情况说明。
(4)产品监督抽验情况(如有)。
(5)如上市后出现了召回,应当说明召回原因、过程与处理结果。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
6、产品检验报告
如医疗器械强制性标准已经修订,应提供产品能够达到新要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械检验机构出具。
7、符合性声明
(1)注册人声明本产品符合《医疗器械注册管理措施》与相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
(2)所提交资料真实性的自我保证声明。
8、其他
如在原医疗器械注册证有效期内出现了涉及产品技术要求变更的,应当提交依据注册变更文件修改的产品技术要求一式两份。
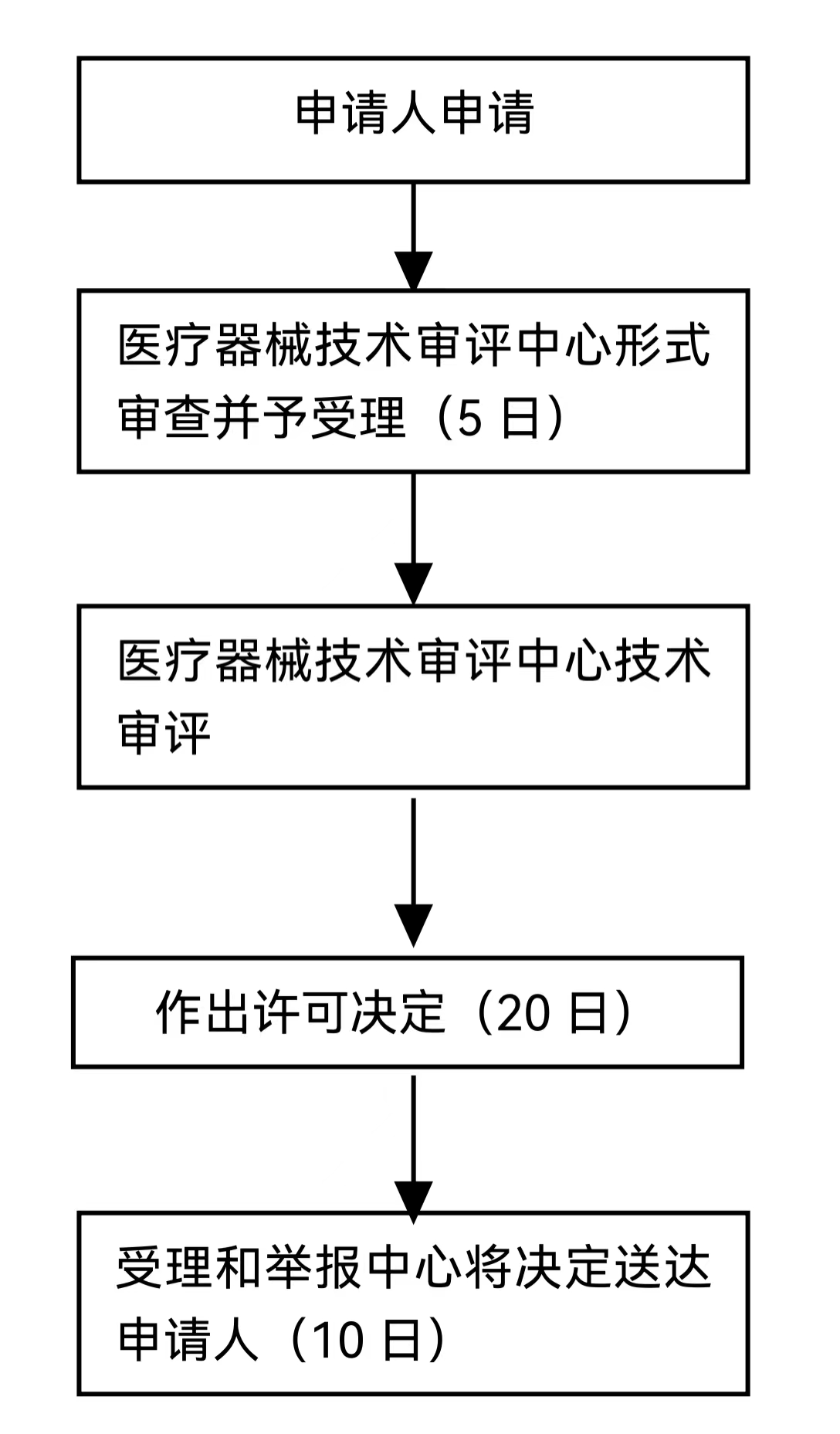
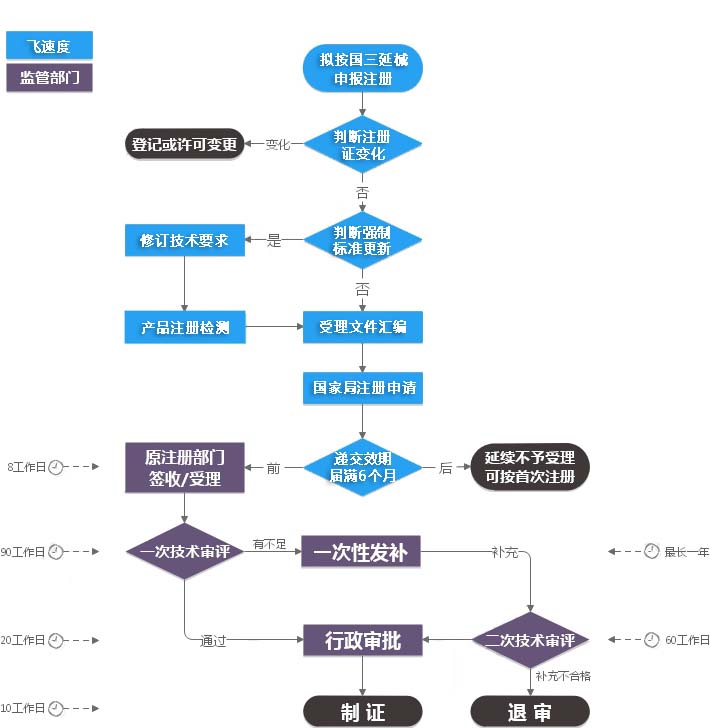
官方办理流程
服务流程
官方收费
项目分类 境内 进口 第三类 首次注册费 15.36 30.88 变更注册费 5.04 5.04 延续注册费
(五年一次)4.08 4.08 临床试验申请费
(高风险医疗器械)4.32 4.32 单位:万元
提交留言