
本指导原则旨在指导注册申请人对细胞色素P450同工酶2C9(Cytochrome P450 2C9,CYP2C9)与维生素K环氧化物还原酶复合体亚基1(vitamin K epoxide reductase complex, subunit 1,VKORC1)基因多态性检测试剂注册申报资料的准备及撰写,同时也为技术审评部门提供参考。
本指导原则是对CYP2C9与VKORC1基因多态性检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。
本指导原则是供注册申请人与技术审评人员使用的指导性文件,但不包括注册审批所涉及的行政事项,也不作为法规强制执行,如有能够满足相关法规要求的其他方法,也可以按照基于,但需要提供详细的研究资料与验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规与标准体系以及当前认知水平下制定的,随着法规与标准的不断改进,以及科学技术的不断发展,本指导原则的相关内容也将适时开展调整。
一、适用范围
本指导原则适用于按照基于PCR法,对预期服用或正在服用华法林药物的患者静脉全血或口腔拭子等样本DNA中的CYP2C9与VKORC1基因多态性开展体外定性检测的试剂,用于华法林的用药指导,且指导原则仅针对该用药指导的特定基因多态性位点检测开展了说明,具体涵盖CYP2C9 *2(rs1799853,c.430C>T)与/或CYP2C9 *3(rs1057910,1075A>C),以及VKORC1 -1639G>A(rs9923231)与/或VKORC1 1173C>T(rs9934438)。
对于CYP2C9与VKORC1其他多态性位点的检测试剂,以及按照基于其他分子生物学检测方法或其他样本类型的检测试剂,可能部分要求不完全适用或本文所述内容不够全面,申请人可参照本指导原则,按照产品特性对适用部分开展评价,并补充其他的评价资料。
本指导原则适用于开展CYP2C9与VKORC1双基因多态性检测且用于华法林指导用药的试剂,对于开展CYP2C9或VKORC1单基因多态性检测且用于华法林用药指导的试剂,适用部分亦可参考本指导原则。
本指导原则适用于CYP2C9与VKORC1基因多态性检测试剂注册申请与变更注册申请的情形。本指导原则针对相关产品注册申报资料中的部分内容开展撰写,其他未尽事宜应当符合《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告》等相关法规要求。
二、注册审查要点
(一)监管信息
1.产品名称及分类编码
产品名称应符合《体外诊断试剂注册与备案管理措施》及相关法规的要求。按照《体外诊断试剂分类规则》,该产品按照第三类体外诊断试剂管理,分类编码为6840。
2.其他信息还包括产品列表、关联文件、申报前与监管机构的联系情况与沟通记录以及符合性声明等文件。
(二)综述资料
综述资料主要包括概述、产品描述、预期用途、申报产品上市历史及其他需说明的内容。其中,产品描述应详述技术原理、产品主要研究结果的总结与评价、与同类与/或前代产品的比较等。与同类与/或前代产品的比较应着重从技术原理、主要组成成分、预期用途、被测靶标(基因多态性位点)、性能指标、临床应用情况等方面详细说明申报产品与已获批准的同类/前代产品之间的主要区别。预期用途应详述基因多态性位点与临床适应证的关系,弄清楚各基因型的出现率等情况,尤其是在中国人群的分布情况。
若被测靶标为新的多态性位点,申请人还应提交支持资料,以证明:1.携带该新位点等位基因所编码的CYP2C9酶或VKORC酶,其活性与稳定性的变化情况;2.对于携带该新位点等位基因的患者,华法林在其体内的代谢过程可能出现的预期改变;3.提供充分的中国人群临床证据,以证明该新位点的临床意义。
(三)非临床资料
1.产品技术要求及检验报告
注册申请人应当在原材料质量与生产工艺稳定的前提下,按照产品研制、前期评价等结果,依据相关文件资料,结合产品特性按照《医疗器械产品技术要求编写指导原则》的要求编写。该类产品作为第三类体外诊断试剂,应当以附录形式弄清楚主要原材料以及生产工艺要求。
第三类体外诊断试剂应当提供三个不同生产批次产品的检验报告。针对已有适用的国家标准品发布的基因多态性位点,技术要求中应体现该位点检测国家标准品的相关要求。可提交申请人出具的自检报告或委托有资质的医疗器械检验机构出具的检验报告。
如有适用的国家标准、行业标准,产品技术要求的相关要求应不低于相应的要求。
2.研究性能研究
注册申请人应按照基于在符合质量管理体系的环境下生产的试剂盒开展所有研究性能研究,并提交详细的性能评估资料,包括试验方案、试验数据、统计研究结果及结论等详细资料。密切相关研究性能研究的背景信息也应在资料中有所体现,包括试验地点,按照基于的试剂名称、规格与批号,适用仪器名称与型号,样本的背景信息(来源、样本编号、样本类型、采集及处理方式、基因型与浓度确认方法及结果)等。研究性能评估用样本一般应为临床样本,对于在中国人群中出现频率较低的某些稀有基因型(CYP2C9 *2位点CT与TT基因型、CYP2C9 *3位点CC基因型),部分研究可按照基于细胞系样本开展配置,须注明细胞系样本来源信息。
如声称多种适用样本类型,注册申请人应针对不仍然本类型分别完成性能评估研究。
研究性能评估的试验方法可参考国际或国内密切相关体外诊断试剂性能评估指导原则开展,对于本类产品建议着重从以下研究性能开展研究。
2.1样本稳定性
样本稳定性研究应按照基于临床样本,主要包括核酸提取纯化前样本的稳定性与提取纯化后核酸的稳定性两方面。在包括最不利情形的条件下储存,每间隔一定的时间段对储存样本开展研究验证。适于冷冻保存的样本还应对冻融次数开展评价。如声称多种适用样本类型,注册申请人应针对不仍然本类型分别开展样本稳定性研究。
2.2适用的样本类型
列明产品适用的样本类型。应按照基于可靠方法对每种样本类型开展适用性研究确认,对于全血样本还需考察不同抗凝剂的适用性。对于不可比样本应分别提交相应的研究性能研究资料。
2.3准确度
按照基于申报产品与核酸序列测定方法或已上市同类产品开展方法学比对研究,评价申报产品的准确度,样本应由若干份临床样本组成,且样本应涵盖CYP2C9 *2位点CC、CT及TT基因型,CYP2C9 *3位点AA、AC与CC基因型,VKORC1 -1639位点AA、AG及GG基因型,VKORC1 1173位点TT、TC与CC基因型。
2.4精密度
精密度评价应按照基于临床样本开展研究,稀有基因型可按照基于细胞系,样本应至少涵盖申报产品所有检测基因的杂合突变型(即CYP2C9 *2位点CT基因型,CYP2C9 *3位点AC基因型,VKORC1 -1639位点AG基因型,VKORC1 1173位点TC基因型)。试验操作应按照说明书执行,包括核酸提取/纯化等样本处理步骤。
精密度评价需满足如下要求:
2.4.1对可能影响检测精密度的主要因素开展验证,除检测试剂(包括核酸提取/纯化组分)本身外,还应考虑仪器、操作者、地点、时间、运行、试剂批次等因素。
2.4.2设定可靠的精密度评价周期,对批内/批间、日内/日间实验室间以及操作者之间的精密度开展综合评价。
2.4.3用于精密度评价的样本建议至少包括检出限附近水平与中/高浓度水平,检测结果应与预期结果一致。
2.4.4申请人应结合产品特点,对精密度指标评价标准做出可靠要求,如CV值。
2.5检出限与检测上限
2.5.1检出限与检测上限的形成
CYP2C9与VKORC1基因多态性检测试剂的检出限为:在满足一定的检测准确性与精密度的条件下,能够检出目标基因的人基因组DNA最低浓度。
可按照基于梯度浓度的人基因组DNA样本开展多次重复检测,确定95%检出率水平下的人基因组DNA最低浓度,即为检出限。系列稀释度应能够覆盖大部分检出概率区间(0~100%),可按照各浓度梯度检测结果直接判定,也可通过适当的模型(如Probit研究)与其他研究方法计算申报产品在设定概率下的检出限,一般在该检测浓度下应具有95%的检出率。
同时,申请人亦应评价CYP2C9与人VKORC1基因多态性试剂可准确检出的人基因组DNA浓度上限,即适当检出率水平下的最高人基因组DNA浓度。
检出限评价应按照基于临床样本或细胞系,并至少包括申报产品所有检测基因的杂合突变型,并提供详细的样本型别与浓度的确定方法。
2.5.2检出限的验证
按照基于与形成不同的临床样本对声称可检测位点的所有基因型开展验证,稀有基因型可按照基于细胞系,对检出限附近浓度水平的样本开展至少20次的重复检测,应满足95%检出率要求。
2.6研究特异性
2.6.1交叉反应
应对与靶基因序列相近或具有同源性序列、易引起交叉反应的基因序列(如CYP2C9及VKORC1的其他突变序列、CYP2C19、CYP2C8、CYP2C18、VKORC1L1、检测靶标外的其他位点突变序列)开展交叉反应验证。
试验方案需弄清楚交叉样本的来源/制备方法、核酸序列确认方式及结果,并提交详细的研究资料。
2.6.2干扰研究
应针对可能的内源与外源性干扰物开展干扰试验研究。干扰物的选择与所用样本类型密切相关,对于全血样本,内源性干扰物质应包括血红蛋白、甘油三酯、胆红素、白蛋白等,外源性干扰物质应包括血液样本采集可能用到的抗凝剂与常用药物(如肝素、华法林、阿司匹林、氯吡格雷、胺碘酮等)。
干扰试验可通过在临床样本中添加干扰物质的方式,评价添加前后干扰物质对靶基因检测的影响,也可直接采集暴露于干扰因素后的受试者样本,开展干扰试验评价。建议在每种干扰物质的潜在最大浓度(“最差条件”)条件下开展评价,如有干扰,应确定不产生干扰的最高浓度。
2.7核酸提取/纯化性能 在开展核酸检测之前,建议有核酸提取/纯化步骤。无论检测试剂是否含有核酸提取/纯化的组分,企业都应结合检测试剂的特性,对配合使用的所有核酸提取试剂开展提取核酸纯度、浓度、提取效率的研究,并评价该方法能否满足CYP2C9与VKORC1基因多态性检测试剂的要求,提供详细的评价资料。
若产品适用可归结成两种或以上核酸提取试剂,则每一种核酸提取试剂均需配合检测试剂开展精密度、检出限与抗干扰的验证。
2.8企业参考品验证
按照主要原材料研究资料中的企业参考品设置情况,按照基于三批产品对企业参考品开展检验并提供详细的试验数据。
2.9反应体系
2.9.1样本采集与处理
请详述样本的采集与处理方式,弄清楚样本的保存介质。
2.9.2反应体系确定
依据产品特性,提供最佳反应体系确定的研究资料,包括但不限于核酸提取用的样本体积、洗脱体积与PCR反应中样本与试剂的加样体积、各试剂组分加样量及反应各阶段温度、时间、循环数等。
如有多个适用机型,需提交不同适用机型基线与阈值确定的研究资料。不同适用机型的反应条件要是有差异应分别详述,并提交验证资料。
3.稳定性研究
申报试剂的稳定性主要包括实时稳定性、开瓶稳定性、运输稳定性、机载稳定性(如适用)及冻融次数限制等研究,申请人可按照实际需要选择可靠的稳定性研究方案。稳定性研究资料应包括具体的实施方案、详细的研究数据、研究结果以及结论。对于实时稳定性研究,应提供至少三批产品在实际储存条件下保存至成品有效期后的研究资料。
4. 阳性判断值研究
对于此类试剂,阳性判断值即为能够获得理想的检测准确性的临界值(Cut-off)。建议纳入一定数量的临床样本,涵盖可检测位点的所有基因型,按照基于受试者工作特征(ROC)曲线的方式开展研究。亦可按照基于其他科学可靠的方法开展阳性判断值研究。相关资料中应详述试验方案、样本数量、样本入组标准、样本背景信息(来源、可溯源编号、性别、年龄等)及试验结果等。如试剂判读存在灰区,应解释说明灰区范围的确定方法。如按照基于其他方法对阳性判断值开展确认研究,应说明这种方法的可靠性。要是产品适用不仍然本类型,需要对各样本类型分别开展阳性判断值研究。
5. 其他资料
5.1主要原材料研究资料
该类产品的主要原材料一般包括引物、探针、酶、dNTP、反应缓冲液、核酸分离/纯化组分(如有)、质控品、参考品等。应提供主要原材料的选择与来源、制备过程、质量控制标准等相关研究资料。如主要原材料为企业自制,应提供其详细制备过程;如主要原材料源于外购,应提供资料包括:选择该原材料的依据及比较筛选试验资料、生产商提供的质量标准、出厂检验报告,以及该原材料到货后的质量检验资料。
5.1.1引物与探针:应详述引物与探针的设计原则,提供引物与探针核酸序列、检测靶序列及两者的对应情况。建议设计两套或多套引物与探针以供筛选,针对待测位点的检测灵敏度与特异性等开展评价,选择最佳引物探针组合,并提交详细的筛选研究数据。同时应针对引物与探针核酸序列及检测靶序列开展同源性比对,如有同源序列应着重评价是否会有交叉反应。
申请人应针对选定的引物、探针原材料开展质量评价,一般包括:序列准确度、分子量、纯度、浓度、探针荧光标记基团,以及功能性试验等,并依据评价结果形成可靠的质量标准。
5.1.2脱氧三磷酸核苷(dNTPs):包括dATP、dGTP、dCTP、dTTP或dUTP,应提交对其纯度、浓度以及功能性试验等验证资料,并确定质量标准。
5.1.3酶:涉及的酶主要包括DNA聚合酶与尿嘧啶DNA糖基化酶(UDG/UNG)等。应分别对酶活性、热稳定性、功能性试验等开展评价与验证,并确定质量标准。
DNA聚合酶应具有DNA聚合酶活性,无核酸内切酶活性,具热稳定性。UDG/UNG应具有水解尿嘧啶糖苷键的活性,无核酸外切酶及核酸内切酶活性。
5.1.4质控品
CYP2C9与VKORC1基因多态性检测试剂的质控品可分别设置声称检测位点所有基因型的DNA样品,同时设置不含待测靶序列的空白质控品用于交叉污染的质控;亦可直接按照基于待测位点的杂合突变型DNA样品及空白质控品开展质量控制。
对于此类产品,一般情况下,反应体系中野生型序列与突变型序列均有阳性反应,可以对管内抑制结果的假阴性结果开展质量控制,则试剂盒中可不另外设置内标对照;否则,应另外设置内标对照。
质控体系应能够对检测全过程开展有效的质量控制,包括试剂及仪器性能、可能的扩增反应抑制物(管内抑制)、交叉污染等因素造成的假阴性或假阳性结果。质控品可按照基于质粒或临床样本的核酸提取液等。空白质控品应参与样本核酸的平行提取。申请人应针对质控品原料选择、制备、定值过程等提供详细的研究数据,并对质控品的检测结果做出弄清楚的范围要求。
5.1.5 核酸提取/纯化试剂(如有)
应提供试剂的主要组成、原理介绍及相关的筛选及验证资料。
5.1.6企业参考品 企业参考品一般包括准确性参考品、特异性参考品、检出限参考品与精密度参考品等,应按照产品性能验证的实际需要设置企业参考品。
申请人应提交密切相关企业参考品原料来源、选择、制备方法、浓度及基因型别确认方法或试剂的研究资料。参考品设置应按照基于临床样本,样本类型与待测样本一致,如涉及稀有基因型别(如CYP2C9 *2位点CT与TT基因型、CYP2C9 *3位点CC基因型,等),可使用细胞系样本。
企业参考品的设置建议如下:
准确性参考品:应包括产品声称可检测位点的所有基因型样本。
特异性参考品:应考虑检测特异性的评价,适当纳入同源序列交叉反应样本、干扰样本等。
检出限参考品:可选择检出限浓度或略高于检出限浓度的样本,应至少包括所有多态性位点的杂合突变型样本。
精密度参考品:建议包括高、低两个浓度的样本,其中一个浓度应为检出限附近的浓度。至少包括所有多态性位点的杂合突变型样本。
5.2生产工艺研究资料
可结合工艺流程图描述生产工艺过程。生产过程应对根本参数开展有效控制,弄清楚根本工艺质控步骤,并详细说明该步骤的质控方法及质控标准。并提交主要生产工艺的确定及优化研究资料。
(四)临床评价资料
临床试验的开展、方案的制定以及报告的撰写等均应符合相关法规及《体外诊断试剂临床试验技术指导原则》(国家药品监督管理局通告2021年第72号)的要求,如相关法规、文件有更新,临床试验应符合更新后的要求。
1.临床试验机构
应选择不少于3家(含3家)已备案的临床试验机构,按照相关法规与指导原则的要求开展临床试验。申请人应按照产品特点及预期用途,综合不同地区人种与流行病学背景等因素选择临床试验机构。临床试验机构应具有分子生物学方法检测的优势,操作人员应熟悉临床试验方案及检测系统的各环节,熟悉临床试验方案。
2.临床试验方法
2.1针对已有同类产品上市的情况
2.1.1对于已有同类产品上市的产品,建议申请人选择境内已批准上市的同类产品或Sanger测序作为比较试剂/方法,按照基于申报产品与之开展比对研究,评价申报产品的临床检测性能。比较试剂/方法的选择应从预期用途、样本要求、检测性能等方面,确认其与申报产品具有较好的可比性。
2.2针对无同类产品上市的情况
2.2.1针对无同类产品上市的新产品,可以选择公认的参考方法(如:Sanger测序法)作为比较方法,确认申报产品的临床检测性能。
2.2.2针对无同类产品上市的新产品,如新的多态性位点用于华法林用药指导已获行业认可(包括:CPIC、国内相关指南或专家共识、相关药物说明书以及临床应用等的认可),且有中国人群的临床证据,可提交上述资料作为其临床意义的支持证据。如新多态性位点用于华法林用药指导尚未有共识性文件支持,应提交基于中国人群的充分的临床数据,证明产品临床意义。
3.受试者选择与样本类型
3.1受试者选择
受试者应为预期服用或正在服用华法林药物的患者,如深静脉血栓形成、肺栓塞、心房颤动、心脏瓣膜置换术后血栓栓塞并发症、心肌梗死后等疾病患者。
3.2样本类型
适用的样本类型一般为静脉抗凝全血,也可能涉及口腔拭子。
如申报产品同时包括静脉全血或口腔拭子样本类型,针对临床检测性能评价,静脉全血样本类型的比较方法应按照基于一致的样本类型检测,对于口腔拭子样本类型,可与按照基于静脉全血样本类型的已上市同类产品开展比较研究,或与静脉全血样本类型开展同源比对。
临床试验中应为临床原始样本,不应直接按照基于提取的基因组DNA开展试验。临床样本的采集、处理、保存与提取等应同时满足申报产品说明书以及比较试剂说明书(如适用)的相关要求。
4.临床试验样本量
针对每个位点,临床试验样本量均建议按照基于单组目标值法开展估算。不同基因型亚组,其符合率的临床可接受标准(P0)建议均不低于95%。
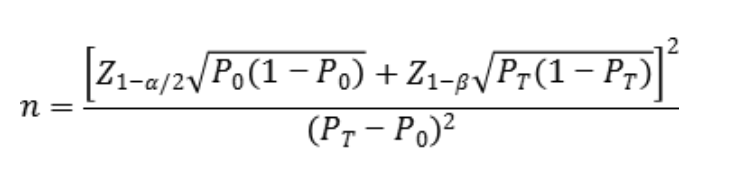
公式中,n为样本量;Z、Z为显著性水平与驾驭度的标准正态分布的分数位,P为评价指标的临床可接受标准,P为申报产品评价指标预期值。
临床试验总体样本量确定时应在上述最低样本量估算的基础上,同时考虑其他可能造成受试者脱落的情况等适当增加入组样本量。
针对CYP2C9*2位点,应分别估算CC基因型亚组的例数,以及CT/TT基因型亚组的例数。其中CT与TT基因型均应有样本入组。
针对CYP2C9*3位点,应分别估算AA基因型亚组的例数,以及AC/CC基因型亚组的例数。其中AC与CC基因型均应有样本入组。
针对VKORC1 1639位点,应分别估算AA基因型亚组的例数,以及AG/GG基因型亚组的例数。其中GG基因型例数不少于30例。
针对VKORC11173位点,应分别估算TT基因型亚组的例数,以及TC/CC基因型亚组的例数。其中 CC基因型例数不少于30例。
如申报产品同时包括静脉抗凝全血与口腔拭子样本类型,临床试验应以静脉全血样本类型为主,样本量满足如上要求,针对口腔拭子样本类型,可按照基于抽样调查的公式开展样本量估算,对不同基因型开展充分验证。
5.统计学研究
应对入组人群开展人口学研究,包括年龄、性别与临床诊断背景信息等。
针对每个基因位点,按照基于3x3表格开展统计研究,计算每个基因型符合率的点估计值,并针对“4临床试验样本量”中涉及的主要基因型亚组计算符合率及其95%置信区间。
在数据收集过程中,对于可归结成两种试剂检测结果纷歧致的样本,建议按照基于可靠方法开展复核,并对差异原因开展研究。
6.伦理学要求
临床试验必须符合赫尔辛基宣言的伦理学准则。研究者应考虑临床试验用样本的获得与试验结果对受试者的风险,提请伦理委员会审查,并获得伦理委员会的同意。注册申报时应提交伦理委员会的审查意见。
7.临床试验方案
各临床试验机构应执行同一临床试验方案,且保证在整个临床试验过程中遵循预定的方案,不可随意改动。整个试验过程应在临床试验机构的实验室内并由本实验室的技术人员操作完成,申报单位的技术人员除开展必要的技术指导外,不得随意干涉实验进程。
试验方案应确定严格的入选/排除标准,任何已入选的样本被剔除出临床试验都应记录在案并弄清楚说明原因。在试验操作过程与结果判定时应按照基于盲法以保证试验结果的客观性。
8.质量控制
临床试验开始前,建议开展临床试验方案的培训,以熟悉并掌握相关试验方法的操作、仪器、技术性能等,最大限度控制试验误差。整个试验过程都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
9.临床试验小结与报告的撰写
按照《医疗器械临床试验质量管理规范》《体外诊断试剂临床试验技术指导原则》的要求,撰写临床试验小结与报告,并且满足签章等要求。临床试验报告应该对试验的整体设计及各个根本点给予清晰、完整的阐述,应该对整个临床试验实施过程、结果研究、结论等开展条理分明的描述,并应包括必要的基础数据与统计研究方法。(五)产品说明书与标签样稿
(五)产品说明书与标签样稿
产品说明书格式应满足《体外诊断试剂说明书编写指导原则》的要求。产品说明书中技术内容应与注册申报资料中的相关研究结果保持一致,如某些内容引用自参考文献,应以规范格式开展标注,并单独列明文献的相关信息。CYP2C9与VKORC1基因多态性检测试剂说明书编写应重点关注以下内容。
1.【预期用途】应至少包括以下几部分内容:
1.1本产品用于体外定性检测人体XX样本中的XX基因XX位点的多态性。
本产品用于华法林的用药指导。
1.2介绍被测靶标(基因多态性位点),规范表述多态性位点,说明基因多态性位点与临床适用症的关系,弄清楚各基因型的临床出现频率。
1.3弄清楚本产品检测结果仅供临床参考,不应作为患者是否用药的唯一依据,临床医生应结合患者病情、疗效及其他实验室检测指标等对本产品的检测结果开展综合判断。
2.【检验原理】
对试剂盒的被测靶标开展详细描述(基因位置、多态性位点及相关特征等),对试剂盒所用探针、引物、多态性的判定方式等开展详细的介绍;对不仍然本反应管组合、质控品设置及荧光信号检测原理等开展介绍。
如反应体系中添加了相关的防污染组分(如UNG酶),也应对其作用机理开展简要介绍。
3.【主要组成成分】 弄清楚试剂盒中各组分及具体成分。弄清楚需要但未提供的材料等信息。
4.【样本要求】 应弄清楚样本采集、处理、保存等各环节要求,说明样本保存条件及期限等。冷藏/冷冻样本检测前是否需要恢复至室温,冻融次数的限制等。
5.【检验方法】
详细说明实验操作的各个步骤,包括:
5.1实验条件:实验室分区、实验环境的温度、湿度与空调气流方向控制等注意事项。
5.2试剂配制方法与注意事项。
5.3简述核酸提取纯化的条件、步骤及注意事项(如适用),对核酸提取纯化环节开展可靠的质量控制,弄清楚提取核酸的浓度纯度等质量要求。
5.4扩增反应前准备:加样体积、顺序等。
5.5 PCR各阶段的温度、时间设置、循环数设置或相应的自动化检测程序及相关注意事项。
5.6仪器设置(如适用):特殊参数、探针的荧光素标记情况、对待测多态性及其他质控品的荧光通道选择等。6.【检验结果的解释】 结合质控品、样本管检测结果以及多态性类型与华法林表型之间的关系,可以列表形式详述所有可能出现的结果及相应的解释。如存在检测灰区,应详述对于灰区结果的处理方式。
7.【检验方法局限性】7.1申报产品仅对XX基因XX位点的多态性开展了验证。
7.2密切相关假阴性结果的概率研究
7.2.1不可靠的样本采集、运送及处理或核酸过度降解均有可能结果检测失败。
7.2.2未经验证的其他干扰或PCR抑制因子等可能会结果假阴性结果(如有)。
7.2.3样本类型如包括口腔拭子,需说明吸烟、进食等行为可能对检测结果的影响。
8.【产品性能指标】
详述以下性能指标:
8.1国家参考品与企业参考品的符合率。8.2对准确度、精密度的研究方法及结果开展总结。
8.3检出限与检测上限:简单介绍检出限的确定方法,并弄清楚检出限结果。
8.4研究特异性
8.4.1交叉反应:说明验证的交叉物质,及有/无交叉反应的浓度水平。
8.4.2干扰物质:说明验证的干扰物质种类,及有/无干扰反应的浓度水平。
8.5临床试验:介绍试验方法、受试者及样本、试验结果与结论等。
9.【注意事项】9.1 本产品仅用于体外诊断。
9.2 如产品含有人源或动物源性物质,应给出具有潜在感染性的警告。
9.3试剂保存运输及使用过程中多种因素可能结果性能变化,如保存运输不当、样本采集、样本处理及检测过程操作不规范等,请严格按照说明书操作。
9.4临床实验室应严格按照《医疗机构临床基因扩增实验室管理措施》等密切相关分子生物学实验室、临床基因扩增实验室的管理规范执行。
(六)质量管理体系文件
申请人应当在申请注册时提交与产品研制、生产密切相关的质量管理体系相关资料。详述产品的生产过程,提供生产工艺流程图。弄清楚申报产品反应及检测原理与过程,标注清楚主要控制点与项目及主要原材料、采购件的来源及质量控制方法。
如适用,应当提供拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的比较说明。
三、参考文献
[1]基于基因变异的呼吸系统疾病多重用药专家共识[J].中国临床药学杂志,2024,33(05):321-333.
[2]张进华,刘茂柏,蔡铭智,等.模型引导的华法林精准用药:中国专家共识(2022版)[J].中国临床药理学与治疗学,2022,27(11):1201-1212.
[3]中华人民共与国国家卫生与计划生育委员会.药物代谢酶与药物作用靶点基因检测技术指南(试行).2015.
[4]陈慧,党爱民,汪芳,等.基因多态性与抗栓药物临床应用专家建议[J].福建医药杂志,2017,39(S1):9-19.
[5]Johnson JA, Caudle KE, Gong L, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Pharmacogenetics-Guided Warfarin Dosing: 2017 Update. Clin Pharmacol Ther. 2017 Sep;102(3):397-404.


 1447
1447

