
本指导原则旨在指导注册申请人对登革病毒NS1抗原检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对登革病毒NS1抗原检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。
本指导原则是供注册申请人与技术审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,要是有能够满足相关法规要求的其他方法,也可以按照基于,但需要提供详细的研究资料与验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规与标准体系以及当前认知水平下制定,随着法规与标准的不断改进,以及科学技术的不断发展,本指导原则相关内容也将适时开展调整。
一、适用范围
本指导原则适用于按照基于免疫层析法、化学发光法、酶联免疫法等基于抗原抗体特异性反应原理,以特定的登革病毒NS1抗原为检测目标,对人血清、血浆或静脉全血等样本中的登革病毒NS1抗原开展体外定性检测的试剂。
登革病毒(Denguevirus,DENV)是登革热的病原体,属黄病毒科(Flavivirade),黄病毒属(Orthoflavivirus),是单股、正链RNA病毒。DENV的基因组长约11kb,两端为非编码区,内部的单一开放读码框依次编码3种结构蛋白(C、prM/M与E)与7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B与NS5)。按照抗原性不同DENV可分为4个血清型(DENV-1、DENV-2、DENV-3与DENV-4),各血清型病毒间抗原性有交叉,每种血清型DENV均可引起登革热与重症登革热。
NS1蛋白是DENV的重要非结构蛋白,在DENV感染的早期大量分泌于患者血液中,登革病毒NS1抗原检测可作为实验室早期诊断的特异性指标。
本指导原则适用于登革病毒NS1抗原检测试剂注册申请与变更注册申请的情形。本指导原则仅针对登革病毒NS1抗原检测试剂注册申报资料中的部分内容开展撰写,其他未尽事宜应当符合《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告》等相关法规要求。
二、注册审查要点
(一)监管信息
1.产品名称及分类编码
产品名称应符合《体外诊断试剂注册与备案管理措施》及相关法规的要求,如登革病毒NS1抗原检测试剂盒(荧光免疫层析法)。按照《体外诊断试剂分类规则》,该产品按照第三类体外诊断试剂管理,分类编码为6840-01-01038
2.其他信息还包括产品列表、关联文件、申报前与监管机构的联系情况与沟通记录以及符合性声明等文件。
(二)综述资料
综述资料主要包括产品概述、产品描述、预期用途、申报产品上市历史及其他需说明的内容。其中,产品描述中应详述检测原理、产品主要研究结果的总结与评价、与同类与/或前代产品的比较等。与同类与/或前代产品的比较应着重从方法学、检验原理、产品主要性能等方面详细说明申报产品与目前市场上已获批同类产品之间的主要区别。
(三)非临床资料
1.产品技术要求及检验报告
1.1产品技术要求
注册申请人应当在原材料质量与生产工艺稳定的前提下,按照产品研制、前期评价等结果,依据国家标准、行业标准及密切相关文献资料,结合产品特性按照《医疗器械产品技术要求编写指导原则》的要求编写。该类产品作为第三类体外诊断试剂,应当以附录形式弄清楚主要原材料以及生产工艺要求。
如有适用国家标准、行业标准,产品技术要求的相关要求应不低于相应的要求。
1.2产品检验报告
如有登革病毒NS1抗原检测试剂国家参考品发布,技术要求中应体现国家参考品的相关要求,并使用国家参考品对三批试剂开展检测。
2.研究性能研究
注册申请人应按照基于在符合质量管理体系的环境下生产的试剂开展所有研究性能研究,提交具体研究方法、试验方案、试验数据、统计研究等详细资料。
如申报产品适用不同的机型,需要提交在不同机型上开展性能评估的研究资料。如申报产品包括不同的包装规格,需要对各包装规格间的差异开展研究或验证。对于不同的样本类型应分别开展验证,对不可比的样本类型应分别提交相应的研究性能评估资料。
研究性能评估所用样本的基本信息均需弄清楚,例如样本来源、样本类型、采集与处理方式、定值过程及数据等。研究中按照基于的登革病毒NS1抗原阳性样本,应按照基于可靠方法确定其阴阳性与滴度/浓度水平,并提交具体的试验资料。研究性能评估用样本一般应为真实样本或病毒培养物,如需稀释应按照基于阴性适用样本基质开展稀释。
2.1样本稳定性
应充分考虑实际使用过程中样本采集、处理、运输及保存等各个阶段的条件,对不同类型样本的稳定性分别开展评价并提交研究资料。内容包括建议的保存条件与运输条件(如涉及)等。
2.2适用的样本类型
列明产品适用的样本类型。
要是试剂盒适用样本类型包括血浆与/或全血样本,可按照基于一定数量血清、血浆、静脉全血同源样本开展比较试验的方法开展验证。
2.3准确度
可按照基于与已上市同类产品或临床参考标准开展方法学比对的方式,同时检测临床样本,比较申报试剂检测结果与已上市同类产品或临床参考标准检测结果之间的一致性程度,开展申报试剂的准确度评价。
样本应选择符合样本稳定性的预期人群样本,研究应纳入一定数量的阴性与阳性样本,并注意包括不同血清型样本及一定数量的阳性判断值附近的样本与干扰样本。
2.4企业参考品验证
按照主要原材料研究资料中的企业参考品设置情况,按照基于三批产品对企业参考品开展检验并提供详细的试验数据。
2.5精密度
应对精密度指标,如标准差或变异系数等的评价标准做出可靠要求(如适用)。应考虑运行、时间、操作者、仪器、试剂批次与地点等影响精密度的条件,设计可靠的精密度试验方案开展评价。
设定可靠的精密度评价周期,例如:为期至少20天的检测,具体方案可参考性能评价相关文件开展。
应按照基于临床样本或病毒培养物开展精密度评价,应至少包括3个水平:阴性样本、检出限水平样本、中/强阳性样本,并按照产品特性设定适当的精密度要求,例如:
阴性样本:待测物浓度为零浓度,阴性符合率应为100%(n≥20)。
检出限水平样本:检测检出限水平样本阳性检出率应不低于95%(n≥20)。
中/强阳性样本:待测物浓度呈中度到强阳性,阳性符合率为100%,且CV≤10%(n≥20),或条带结果显色均一。
2.6检出限
2.6.1检出限的确定
将不同来源的至少3份登革病毒NS1抗原阳性样本或病毒培养物分别梯度稀释于与适用样本类型一致的阴性基质中,开展检出限的确定。每个浓度梯度重复检测不少于20次,将具有95%阳性检出率的浓度水平作为检出限。
申请人应至少针对DENV-1与DENV-2分别开展检出限确定研究。2.6.2检出限的验证另外选择具有时间与区域特征性的至少3个临床样本或病毒培养物在检出限浓度水平开展验证,应达到95%阳性检出率。
检出限验证应针对四种血清型的登革病毒分别开展研究。
应提供详细的病毒滴度/浓度的确定方法,同时应详细描述病毒样本的确认方法及验证结果。
2.7包容性
验证样本应覆盖DENV-1、DENV-2、DENV-3、DENV-4四种血清型,每种血清型使用具有时间与区域特征性的不同来源的多例样本开展验证,验证内容应包括重复性、检出限等,提供样本及浓度的确认方法、试验数据。
包容性使用的样本与检出限验证使用的样本应为不同的样本。
2.8研究特异性
2.8.1交叉反应验证用于登革病毒NS1抗原检测试剂交叉反应验证的病原体种类主要考虑以下几方面:抗原结构的同源性、易引起一致或相似的临床症状、采样部位正常寄生或易并发的其他微生物。具体目录请参见表1。
建议在病毒与细菌感染的医学相关水平开展交叉反应的验证。通常,细菌感染的水平为106cfu/ml或更高,病毒为105pfu/ml或更高。申请人应提供所具有作用于交叉反应验证的病毒与细菌的来源、种属/型别与浓度确认等试验资料。 密切相关交叉反应验证的信息应在产品说明书的【产品性能指标】项中有所体现。
表1 推荐用于交叉反应性研究的微生物
西尼罗病毒 | 日本脑炎病毒 (乙型脑炎病毒) | 圣路易脑炎病毒 |
黄热病毒 | 甲型肝炎病毒 | 乙型肝炎病毒 |
丙型肝炎病毒 | 爱泼斯坦巴尔病毒(EB病毒) | 麻疹病毒 |
钩端螺旋体病 | 巨细胞病毒 | 东方马脑炎病毒 |
基孔肯雅病毒 | 甲型与乙型流感病毒 | 带状疱疹病毒 |
肺炎支原体 | 蜱传脑炎病毒 (森林脑炎病毒) | 疟原虫 |
梅毒螺旋体 | 人类免疫缺陷病毒 | 风疹病毒 |
弓形虫 | 布鲁氏杆菌 | 大别班达病毒 (新布尼亚病毒) |
疱疹病毒 | 东方立克次体 | 寨卡病毒 |
戊型肝炎病毒 |
2.8.2干扰实验
干扰物质包括内源性干扰物质与外源性药物。内源性干扰物质应至少包括:血红蛋白、白蛋白、胆红素、甘油三酯、胆固醇、类风湿因子、自身抗体等;外源性药物应包括表2中内容。
建议申请人在每种干扰物质的潜在最大浓度(最差条件)在待测登革病毒NS1抗原检出限水平与阴性水平,开展干扰实验验证。对于常见药物干扰试验,建议参照相应药物药代动力学研究确定的治疗药物浓度添加相应药物开展干扰验证。
表2 用于开展干扰研究的常见外源性药物
泼尼松 | 地塞米松 | 卡巴克洛 |
对乙酰氨基酚 | 利巴韦林 | 阿莫西林 |
氨苄青霉素 | 咖啡因 | 阿司匹林 |
布洛芬 | 地西泮 | 波尼松 |
2.9高剂量钩状效应
应评估高剂量钩状效应并提交研究资料。
建议按照基于高浓度的待测登革病毒NS1抗原阳性样本开展梯度稀释后分别检测,每个梯度重复3至5次,将显色深度或检测信号值随浓度升高反而变浅或减少时的浓度,作为不出现钩状效应时的最高浓度。
2.10反应体系
2.10.1反应条件确定:注册申请人应考虑反应时间、判读时间、反应温度、洗涤液体积与洗涤次数(如涉及)等条件对产品性能的影响,通过试验确定上述条件的最佳组合。
2.10.2反应体系中样本加样方式及加样量确定:通过试验确定最佳的加样方式及加样量。如样本需采取稀释或其他必要的方法开展处理后方可用于最终检测,还应对样本稀释液及其用量、其他必要的处理方法等开展研究。
3.稳定性研究资料
稳定性研究主要包括实时稳定性、开瓶/开封稳定性、运输稳定性等,注册申请人可按照实际需要选择可靠的稳定性研究方案。稳定性研究资料应包括研究方法的确定依据、具体的实施方案、详细的研究数据以及结论。对于实时稳定性研究,应提供至少三批样品在实际储存条件下保存至成品有效期后的研究资料。
4.阳性判断值研究
提交对申报试剂阴性/灰区/阳性等结果判断的阳性判断值(cut-off,CO)确定的研究资料,包括具体的试验方案、人群及受试者样本选择、评价标准、统计学研究与研究数据等。阳性判断值研究用样本来源应具有多样性与代表性,考虑不同年龄、感染阶段及不同血清型等因素,尽量纳入含有干扰物质或其他易引起交叉反应病原体的样本。要是产品适用不仍然本类型,需要对所有样本类型开展阳性判断值的验证。
如适用,可按照基于受试者工作特征曲线(receiver operating characteristic curve, ROC)的研究方式来选择确定可靠的阳性判断值;如结果存在灰区(equivocal zone),应弄清楚灰区形成的基础。如按照基于其他方法对阳性判断值开展确认研究,应说明这种方法的可靠性。
提交阳性判断值研究所用样本的背景信息列表,至少包括性别、年龄、临床诊断信息、样本来源机构等信息。
5.其他资料
5.1主要原材料研究资料
此产品的主要原材料包括抗体、质控品(线)、参考品等。应提供主要原材料的选择与来源、制备过程、质量控制标准等相关研究资料。如主要原材料为企业自制,应提供其详细制备过程;如主要原材料源于外购,应提供资料包括:选择该原材料的依据及比较筛选试验资料、生产商提供的质量标准、出厂检验报告,以及该原材料到货后的质量检验资料,生产商应固定,不得随意更换。
5.1.1特异性抗体
特异性抗体(如抗登革病毒NS1单克隆抗体等)是该类产品的根本原材料。因为登革病毒包括4种不同血清型,且不同地域、不同人群感染的毒株之间可能存在差异,因此在选择抗体原料时,应关注结合表位的选择,避免毒株间差异造成的假阴性,原材料研究资料中应详述该方面的考虑。
应详述抗体所针对的抗原表位、抗体制备所用免疫原以及确定该抗体作为主要原材料的依据,此外应提交抗体来源、制备、筛选、鉴定及质量标准(外观、蛋白浓度、纯度、分子量、效价、功能性试验等)等详细试验资料。
自制抗体,如使用天然抗原作为免疫原,应提供该天然抗原的来源;如使用重组抗原或其他人工合成抗原作为免疫原,应提供相应的核酸或者蛋白序列信息。针对抗体的制备、鉴定等过程,应提交详细的研究资料与工艺稳定性验证资料。
外购抗体,应详述抗体的名称及生物学来源,供应商名称;提交供应商选择的研究资料及供应商出具的抗体性能指标及检验报告。
建议按照基于企业参考品及临床真实样本开展原材料的筛选,应当提供阴阳性检测结果、色度及彩色照片。
5.1.2其他原料
除上述原材料外,产品中还包括其他原料,如胶体金、荧光微粒、磁微粒、硝酸纤维素膜、微孔板、发光底物、标记物等,均应开展选择及验证,并提交相关资料。弄清楚供应商与质量控制标准。
5.1.3试剂盒质控品/质控线
产品应设置可靠的质控品/质控线。质控品应至少包括阴性与阳性两个水平,免疫层析类产品应包括质控线。提交相关原料的来源、选择与阴、阳性确认等相关研究资料,弄清楚供应商与质量控制标准。注册申请人应对质控品/质控线的检测结果做出弄清楚的范围要求(试验有效性的判断)。
5.1.4企业参考品
该类产品的企业参考品一般包括阳性参考品、阴性参考品、检出限参考品与重复性参考品。应按照产品性能验证的实际需要设置企业参考品。
应提交企业参考品的原料来源、选择、制备、阴阳性及浓度/滴度确认方法或试剂等相关验证资料。企业参考品可按照基于临床样本或者使用病毒培养物添加阴性适用样本基质开展制备。企业参考品的设置建议如下:
5.1.4.1阳性参考品
阳性参考品设置应考虑覆盖4种不同的血清型,并包括不同的浓度水平。
5.1.4.2阴性参考品
阴性参考品应考虑检测特异性的评价,纳入正常临床样本、除待测登革病毒外含有黄热病毒、乙型脑炎病毒、丙型肝炎病毒、乙型肝炎病毒、麻疹病毒等其他病原体阳性的样本。
5.1.4.3检出限参考品
可设置系列稀释梯度样本,其中应包括检出限水平,应针对四种不同血清型的登革病毒分别设置。
5.1.4.4重复性参考品
建议包括高、低两个浓度的样本,其中一个浓度应为检出限附近的浓度。
5.2生产工艺的研究资料
5.2.1产品基本反应原理介绍。
5.2.2生产工艺介绍,可用流程图方式表示,并简要说明主要生产工艺的确定依据。
5.2.3包被/标记工艺研究,注册申请人应考虑如包被/标记液量、浓度、时间、条件等指标对产品性能的影响,通过试验确定上述指标的最佳组合。
5.2.4显色系统、酶作用底物等的介绍以及最适条件研究。
(四)临床评价资料
临床试验的开展、方案的制定以及报告的撰写等均应符合相关法规及《体外诊断试剂临床试验技术指导原则》的要求,如相关法规、文件有更新,临床试验应符合更新后的要求。
1.临床试验机构
登革热属于区域性传染性疾病,建议申请人在相关流行病学多发区域选择临床试验机构,应为经备案的医疗器械临床试验机构。临床试验机构数量应不少于3家,且具有免疫学方法检测的优势,实验操作人员应有足够的时间熟悉检测系统的各环节(仪器、试剂、质控及操作程序等),熟悉评价方案。在整个实验中,试验体外诊断试剂与比较方法均应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
2.临床试验设计
临床试验可选择已上市的同类产品作为比较试剂,比较试剂在预期用途、适用人群、样本类型、检测方法学、检测性能等方面应与试验体外诊断试剂具有较好的可比性。
3.临床试验入组人群
临床试验的入组人群应为产品的预期适用人群,该产品的适用人群为具有登革热相关症状/体征的人群。临床试验方案中应按照相关研究数据弄清楚受试者入组标准,并说明依据。入组受试者应能够代表产品适用人群的各种情形,应包括按照《登革热诊疗指南》所确定的确诊病例、临床诊断病例、疑似病例。同时还应包括不同年龄、不同性别受试者、不同疾病进展期(发热期、极期)的病例。同时还应入组部分需要开展鉴别诊断的其它发热伴出疹性疾病病例开展特异性评价。
应注意临床试验中应纳入登革病毒的不同血清型的受试者,应包括DEN-1~4型等不同型别。
4.临床试验样本类型
样本类型一般为血清、血浆、静脉全血等。对于血清与血浆样本,如经临床前研究证明研究性能没有差异,则临床试验中可开展汇总统计。血清/血浆与静脉全血样本,可按照基于同源比对的方式开展临床评价。
临床样本的处理、保存等应分别满足申报产品说明书及比较试剂说明书的相关要求。
5.临床试验样本量
与比较试剂比较研究的临床试验样本量应满足统计学要求,可按照基于适当的统计学方法开展估算。临床试验可依据试验用体外诊断试剂相对于比较方法的阴阳性符合率分别估算最低阴阳性样本例数。
临床样本量的估算建议按照基于如下样本量公式计算,
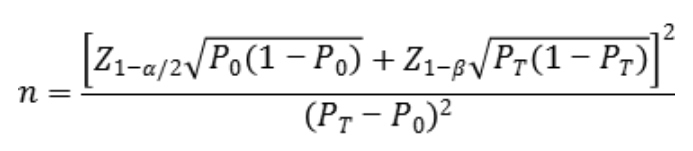
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平与驾驭度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为试验体外诊断试剂评价指标预期值。其中,阴阳性符合率的临床可接受标准(P0)建议不低于90%。
临床试验总体样本量确定时应在上述阴、阳性样本最低样本量估算的基础上,同时考虑其他可能造成受试者脱落的情况适当增加入组样本量。
对于血清/血浆与静脉全血的同源比对部分,阳性及阴性样本应分别不少于70例。
6.临床试验结果的统计研究
应开展描述性研究,对入组人群的人口学开展研究,包括年龄、性别、临床诊断背景等。
此类产品的临床试验目的在于验证试验体外诊断试剂与已上市同类产品的一致性,统计研究一般以四格表的形式对结果开展总结,并计算试验体外诊断试剂与比较试剂的阳性符合率、阴性符合率、总符合率及其相应的95%置信区间。
同时应针对确诊病例、临床诊断病例与疑似病例开展分层研究。
临床试验中所有纷歧致结果均应结合患者的流行病学背景、临床症状、疾病转归等信息开展充分的研究。
7.境外临床试验数据的认可
境外临床试验数据应符合《接受医疗器械境外临床试验数据技术指导原则》与《使用体外诊断试剂境外临床试验数据的注册审查指导原则》的相关要求。提交完整的临床试验方案、报告与伦理审查意见,以及该数据适用于中国患者人群的论证资料、境内外临床试验质量管理差异的比较资料与临床试验质量管理差异对于临床试验结果影响的论证资料。
注册申请人应按照上述临床试验技术审评要求,论证境外临床试验数据的充分性。
8.临床证据的形式要求
申请人应按照《体外诊断试剂注册与备案管理措施》《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告》等法规文件要求提交各机构伦理审查意见、临床试验方案、临床试验小结、临床试验报告以及临床试验数据库。
临床试验数据表作为临床试验小结的附件提交。数据表中应包括唯一且可溯源的样本编号、年龄、性别、样本类型、临床诊断背景信息、发病时间、采样时间、试验体外诊断试剂检测结果、比较试剂的检测结果等。
(五)产品说明书与标签样稿
产品说明书格式应满足《体外诊断试剂说明书编写指导原则》的要求。产品说明书的所有内容均应与注册申请人提交的注册申报资料的相关研究结果保持一致。如某些内容引用自参考文献,则应以规范格式对此内容开展标注,并单独列明参考文献的相关信息。
产品说明书编写建议参考附件中的模板。
1.【预期用途】
1.1本产品用于体外定性检测人血清、血浆或静脉全血样本中的登革病毒NS1抗原。
1.2简单介绍登革病毒的病原学特征、流行病学特征、NS1抗原的结构特征以及临床表现与现有诊断方法等。
1.3待测人群特征介绍:按照《登革热诊疗指南》确定的疑似登革病毒感染的人群。
2.【检验原理】
描述试剂盒的技术原理,可结合图示开展说明。
3.【主要组成成分】
3.1详细说明试剂盒内各组分的名称、数量、成分、浓度等信息,如含有生物源性物质,应说明其(生物学)来源、活性及其他特性;对于免疫层析法试剂应描述试剂条/卡结构组成。说明不同批号试剂盒中各组分是否可以互换。
3.2试剂盒中不包括但对该项检测必需的组分,应列出相关试剂的生产企业、产品名称、注册证号/备案号或货号等信息。
4.【储存条件及有效期】
说明试剂盒的效期稳定性、开封稳定性等,应标注清楚具体的储存条件及效期,弄清楚温度、湿度(如适用)要求。
5.【适用仪器】(如适用)
注明所有适用的仪器型号,并提供与仪器密切相关的重要信息以指导用户操作。酶标仪应弄清楚波长要求。
6.【样本要求】
说明对样本采集、处理、保存等方面的要求,包括采样要求、运送条件、保存条件及效期、冻融要求、预处理方法等,相关内容应经过前期验证。
7.【检验方法】
7.1试验环境:检测试剂及样本的复温要求、湿度要求(如适用)等。
7.2试剂配制方法,试剂开封后使用方法等。
7.3样本稀释的方法。
7.4试验条件:操作步骤、温度、时间、仪器条件等。
7.5质量控制:操作步骤,质控结果的要求(试验有效性的判断),质控结果不符合要求的处理方式。
7.6可按照基于图示形式显示正确的检验操作方法、程序及注意事项等。特别注意应强调操作温度及湿度条件、读取结果的时间。
7.7特别说明检验操作过程中的注意事项。
8.【阳性判断值】
弄清楚阳性判断值,简要描述阳性判断值确定的试验方法。
9.【检验结果的解释】
描述检测结果的判定标准或计算方法,如有灰区判定,应详细说明灰区样本的处理方法。建议可按照基于图示形式描述结果判读方法。
10.【检验方法的局限性】
综合产品的预期用途、临床背景、检测方法及适用范围等信息,对可能出现的局限性开展相关说明。例如:
10.1本试剂盒的检测结果仅供临床参考,对患者的临床诊治应结合其症状/体征、病史、其他实验室检查及治疗反应等情况综合考虑。
10.2密切相关假阳性结果的概率研究
要是样本在运输、处理过程中出现交叉污染,则可能结果假阳性结果;
试验过程中使用的耗材、设备等受污染,则可能结果假阳性结果。
10.3密切相关假阴性结果的概率研究
10.3.1不可靠的样本采集、转运、储存及处理、样本中病原体含量过低均有可能结果假阴性结果;
10.3.2未经验证的其他干扰因素,可能会结果假阴性结果(如有)。
11.【产品性能指标】
简述以下性能指标:
11.1国家标准品与企业参考品符合情况。(如适用)
11.2检出限:简要介绍评价方法、所用病毒株或样本情况以及评价结果。
11.3对包容性的研究情况开展总结。
11.4对精密度的研究情况开展总结。
11.5研究特异性
11.5.1交叉反应:详述交叉反应验证的病原体种类,及有/无交叉反应的浓度水平。
11.5.2干扰物质:说明验证的干扰物质种类及有/无干扰反应的浓度水平。
11.6钩状(HOOK)效应:对高剂量钩状效应的验证情况开展总结。
11.7临床试验:简要介绍试验方法、受试者及样本、试验结果与结论等。
12.【注意事项】
密切相关试验操作、样本保存及处理等注意事项。
三、参考文献
[1] 国家市场监督管理总局.体外诊断试剂注册与备案管理措施:国家市场监督管理总局令第48号[Z].
[2] 国家药品监督管理局.关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告:国家药品监督管理局公告2021年第122号[Z].
[3] 国家药品监督管理局.体外诊断试剂临床试验技术指导原则:国家药品监督管理局2021年第72号[Z].
[4] 国家药监局医疗器械技术审评中心.定性检测体外诊断试剂研究性能评估注册审查指导原则:国家药监局医疗器械技术审评中心2022年第36号[Z].
[5] 中华人民共与国卫生行业标准. 登革热诊断: WS 216-2018[S]. 中华人民共与国国家卫生与计划生育委员会,2018: 3.
[6] Class II Special Controls Guideline: Dengue Virus Nucleic Acid Amplification Test Reagents, Guideline for Industry and Food and Drug Administration Staff, September 2014, FDA.
[7] 中华人民共与国国家卫生健康委员会,国家中医药局.登革热诊疗方案(2024版)[J]. 新发传染病电子杂志,2024, 9(5): 89-93.
[8] 中华医学会感染病学分会,中华医学会热带病与寄生虫学分会,中华中医药学会急诊分会.中国登革热临床诊断与治疗指南[J]. 传染病信息,2018, 31(5): 385-392.



 1409
1409

