本指导原则旨在指导注册申请人对胎儿染色体非整倍体(T21、T18、T13)检测试剂盒注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对该类试剂的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。
本指导原则是供注册申请人与技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。要是有能够满足相关法规要求的其他方法,也可以按照基于,然而需要提供详细的研究资料与验证资料。
本指导原则是在现行法规与标准体系以及当前认知水平下制定,随着法规与标准的不断改进,以及科学技术的不断发展,相关内容也将适时开展调整。
一、适用范围
胎儿染色体非整倍体(Fetal Chromosome Aneuploidies)中的21三体、18三体、13三体(Trisomy21、Trisomy18、Trisomy13,即T21、T18、T13)是临床上最常见的染色体非整倍体疾病。其对应的分别为21-三体综合征(又称唐氏综合征,先天愚型或Down综合征)、18-三体综合征(又称Edwards综合征)与13-三体综合征(又称Patau综合征),发病率分别约为1/700、1/6000、1/10000,患儿绝相当一部分存在严重智力障碍及器官畸形。
产前筛查与产前诊断是为避免产生遗传缺陷患儿提供的手段。常规的产前筛查方法包括:早孕期的超声与血清学联合筛查与中孕期母体血清学筛查。筛查结果为高风险的孕妇经建议通过产前诊断开展最终确认,由孕妇知情选择。胎儿染色体异常的产前诊断金标准为介入性产前诊断手术,即通过绒毛取材术/羊膜腔穿刺术/经皮脐血管穿刺术,取相应细胞按照基于细胞生物学方法对胎儿染色体开展核型研究。
高通量测序方法检测胎儿染色体非整倍体的原理是:孕妇母体血浆中存在胎儿游离脱氧核糖核酸,长度约为75bp—250bp,几乎全部来源于胎盘的滋养层细胞,其浓度与孕周密切相关并以一定比例(5%—30%)稳定存在于母体外周血浆中。高通量测序方法通过取母体血浆提取包括正常母体与胎儿的血浆游离脱氧核糖核酸(cell free Deoxyribonucleic acid,cfDNA),经文库构建等过程,最后开展上机测序,通过软件研究数据获得染色体数目评价结果。以检测21三体综合征为例,当对怀有T21胎儿的母体血浆游离DNA数据开展研究时,其21号染色体游离DNA总数会有小比例的升高,通过统计学算法区分这一微小差异来实现利用cfDNA开展胎儿染色体非整倍体的产前筛查。但高通量测序法不能对染色体结构异常开展检测,不能代替传统筛查中的开放式神经管缺陷筛查等。
本指导原则所述的胎儿染色体非整倍体(T21、T18、T13)检测试剂盒即通过高通量测序法检测孕妇外周血血浆中胎儿游离脱氧核糖核酸,通过研究样本中的胎儿游离DNA的21号、18号及13号染色体数量的差异,预期用于对胎儿染色体非整倍体疾病21-三体综合征、18-三体综合征与13-三体综合征开展产前筛查的检测试剂盒。
本指导原则所述的高通量测序法,即测定单元高度并行化、单次读长相对较短的基因测序技术类型。基于单分子实时测序原理的测序方法文中并未涉及,如在企业参考品设置、性能评估或临床评价等方面有适用部分,可以参照执行。
本指导原则所述检测试剂盒的适用人群为:对孕周为12+0周及以上的孕妇开展产前筛查,其结果不能代表对孕妇怀有三体胎儿的确认,产前筛查的结果必须要经过产前诊断开展确认。
伦理学原则应遵守国家相关法律法规及行业规定。
二、注册审查要点
(一)监管信息
1.产品名称及分类编码
产品名称应符合相关法规的要求。按照《体外诊断试剂分类规则》,该产品按照第三类体外诊断试剂管理,分类编码为6840。
2.其他信息还包括产品列表、关联文件、申报前与监管机构的联系情况与沟通记录以及符合性声明等文件。
(二)综述资料
综述资料主要包括概述、产品描述、预期用途、申报产品上市历史及其他需说明的内容。其中,产品描述应详述技术原理、产品主要研究结果的总结与评价、与同类与/或前代产品的比较等。与同类与/或前代产品的比较应着重从方法学、技术路线及性能指标(如:检出限)等方面写明拟申报产品与目前市场上已获批准的同类产品之间的主要区别。
综述资料应详细阐明检测原理、检测流程、生信研究过程及数据质量标准,可结合图示弄清楚一个完整检测配合使用的全部试剂及耗材名称、生产厂家、货号、注册证号或备案号、详细的组成成分及试剂作用等。
(三)非临床资料
1.产品技术要求及检验报告
注册申请人应当在原材料质量与生产工艺稳定的前提下,按照产品研制、前期评价等结果,依据国家标准、行业标准及密切相关文献资料,结合产品特性按照《医疗器械产品技术要求编写指导原则》的要求编写。该类产品作为第三类体外诊断试剂,应当以附录形式弄清楚主要原材料以及生产工艺要求。
第三类体外诊断试剂应当提供三个不同生产批次产品的检验报告。如该项目已有国家标准品,技术要求中应体现国家标准品的相关要求,并使用国家标准品开展检验。
可提交以下任一形式的检验报告:
(1)注册申请人出具的自检报告。
(2)委托有资质的医疗器械检验机构出具的检验报告。
要是拟申报试剂已有相应的国家/行业标准发布,建议性能指标要求不低于上述标准要求。
2.研究性能评估资料
注册申请人应提交在符合质量管理体系的环境下生产的试剂盒开展的所有研究性能评估资料,对于每项研究性能的评价都应包括研究目的、试验设计、研究方法、可接受标准、试验数据、统计方法等详细资料。密切相关研究性能评估的背景信息也应在申报资料中有所体现,包括试验地点(实验室)、人员及数量、仪器名称与型号、试剂名称、规格与批号、临床样本来源(如涉及)等。研究性能评估的试验方法可以参考国际或国内密切相关体外诊断产品性能评估的指导原则开展。建议着重对以下研究性能开展研究:
2.1样本稳定性
一般包括样本采集处理、运输及储存(如:冷藏、冷冻)条件下的有效期验证以及血浆游离DNA提取后储存条件的验证。可以在可靠的温度范围内,每间隔一定的时间段对储存样本开展检测,从而确认样本的稳定性。对于冷冻保存的样本还应对冻融次数开展评价。
2.2最低检出限
2.2.1最低检出限形成
通过对企业参考品开展梯度稀释并多次检测,将具有95%阳性检出率的胎儿游离DNA浓度水平作为最低检出限,同时还应对不同基因组DNA浓度可检出胎儿DNA的最小浓度开展评价,确定申报产品最低检出限为XX DNA浓度下可检出胎儿DNA的最小百分比。
2.2.2最低检出限验证
建议按照基于T21、T18、T13胎儿DNA片段按不同比例梯度与正常女性血浆混合制备模拟样本,并稀释至最低检出限水平,通过多次重复检测,应满足至少95%检出。
模拟样本以及企业参考品应使用公认的准确定量方法开展确认,形成与验证样本不应重复。
2.3企业参考品验证
按照主要原材料研究资料中的企业参考品设置情况,按照基于三批产品对企业参考品开展检验并提供详细的试验数据。
2.4精密度
注册申请人可按照不同产品特征或企业的研究习惯开展精密度评价,应保证研究的科学可靠性,试验方法可以参考相关的美国临床实验室标准化协会批准指南(CLSI-EP)或国内密切相关体外诊断产品性能评估的指导原则开展。针对本类产品的精密度评价主要包括以下要求:
2.4.1对可能影响检测精密度的主要变量开展验证,除检测试剂(包括核酸分离/纯化组分)本身的影响外,应对高通量基因测序仪、操作者、地点、可靠的精密度评价周期、试剂批次等要素开展相关的验证。
例如:为期至少XX天的连续检测,每天至少由2人完成不少于2次的完整检测,从而对批内/批间、日内/日间以及不同操作者之间的精密度开展综合评价。注册申请人还应选择不同的实验室开展重复实验以对室间精密度开展评价。
2.4.2用于精密度评价的模拟样品与临床样本均应至少包括3个水平:阴性样品、临界阳性样品、(中或强)阳性样品,并按照产品特性设定适当的精密度要求。精密度评价中的每一次检测均应从核酸提取开始。
2.4.3可结合产品的特点,对每项精密度指标的评价标准做出可靠要求,如标准差或变异系数的范围等。
2.5特异性
2.5.1干扰试验:包括内源性干扰物质与外源性干扰物质。应针对可能存在的干扰情况开展验证。建议注册申请人在干扰物质的潜在最大浓度(即“最差条件”)条件下开展评价。内源性干扰物质的评价至少应包括胆红素、游离血红蛋白、甘油三酯。
2.5.2:对以下是否干扰T21、T18、T13阴阳性的检出能力开展评价:
2.5.2.1微缺失、微重复评价:注册申请人应按照基于一定比例的微缺失、微重复胎儿DNA与正常女性血浆混合制备微缺失、微重复模拟样本开展评价。
2.5.2.2嵌合体评价:申请人应按照基于不同嵌合比例的模拟T21、T18与T13嵌合体样本对试剂检测嵌合体的能力开展评估,对不能检测到的模拟嵌合体的嵌合比例开展确认。
2.5.2.3对其他常见染色体样本的干扰开展评价。
微缺失微重复模拟样本、嵌合体模拟样本及其他常见染色体样本的类型与数量由注册申请人选择确定,并在产品说明书中弄清楚。
2.6反应体系研究
反应体系研究指完成检测所涉及到的最佳反应条件的选择确定过程,包括对提取纯化步骤、游离DNA片段的末端修复、接头及标签连接、文库定量、片段扩增、测序反应的反应条件及反应体系的选择确定,涉及到对样本类型、样本用量、试剂用量、缓冲体系的选择、反应温度与时间条件及检测过程中质控方法确定的依据。重点关注:酶浓度、引物浓度、dNTP浓度、离子浓度、加样量及反应体积、片段扩增各阶段温度、时间及循环数、测序数据质量的评估指标等,其中加样量与反应体积应参考相应行业标准,经研究验证后确定。
此外,还应对数据量及胎儿游离DNA浓度与比例对检测结果的影响开展研究。
3.稳定性研究资料
稳定性研究资料应包括研究方法的确定依据、具体的实施方案、详细的研究数据以及结论。
申报产品的稳定性研究主要包括实时稳定性(有效期)、运输稳定性、开瓶稳定性及冻融次数限制等研究。对于实时稳定性研究,应提供至少三批申报产品在实际储存条件下保存至成品有效期后的研究资料。
运输稳定性、开瓶稳定性等研究实际上均指经运输或开瓶后对产品效期及检测性能是否有影响,因此注册申请人应在试验设计中充分考虑上述因素。
4.阳性判断值研究
因为目前胎儿染色体非整倍体T13、T18、T21的阳性判断值存在多种计算方式,且更好的算法与数据处理方式仍在不断开发中。因此,如注册申请人选择了某一算法作为阳性判断值的计算方式,则应详细阐述选择该算法作为阳性判断值依据的原因(如权威文献、行业共识),并详细阐述计算公式与各参数代表的意义。
以大样本量常用的Z-值(Z-score)算法来举例说明:
4.1 Z-值这个统计量反应的是当前数值距离平均数的相对标准距离,Z-值的应用条件为大样本量以及数据符合正态分布,计算公式如下:
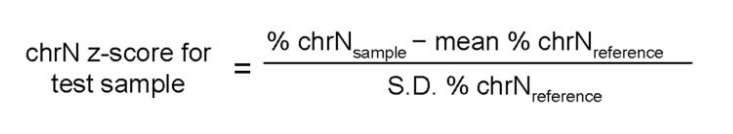
4.1.1 chrN z-score for test sample:所检测样本的Z-值;
4.1.2N:指定的第N染色体;
4.1.3 %chrNsample:待测样品第N条染色体唯一比对序列数占常染色体的百分比,通过高通量测序后软件研究获得;
4.1.4Mean%chrNreference:参照样品第N条染色体比例平均值;
4.1.5 S.D.%chrNreference:参照样品第N 条染色体比例的标准偏差。
该公式中,影响唯一比对序列的因素包括GC含量、检验覆盖度等,注册申请人应计算并统计检验覆盖度是否在正常范围内。参照样品的数量、来源等均对其数据产生影响,进而影响Mean%chrNreference与S.D.%chrNreference。因此,注册申请人需对参照样品的数据计算开展详述,并提供计算值。
4.2 被筛查孕妇所怀胎儿的染色体数量状况符合正态分布,即大概率为正常染色体数量,小概率事件为胎儿染色体非整倍体,如图1所示:
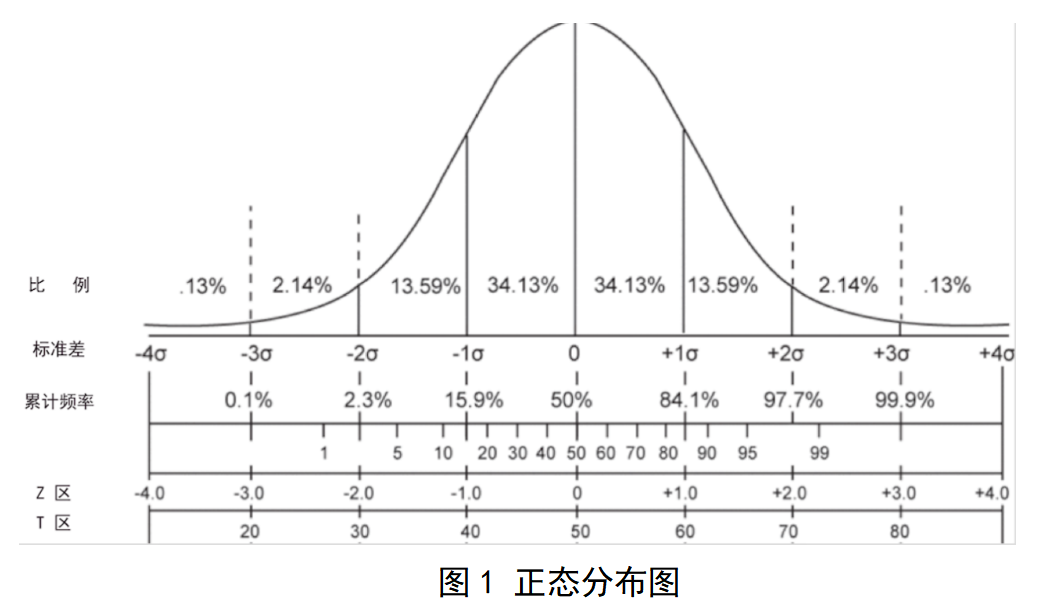
如图1可以看出,出现在Z-值为正负3以外的数值,则有99.9%的可能为阳性,因此,通常将Z-值=3定为阳性判断值分界点,Z-值>3或Z-值<-3判断为胎儿染色体非整倍体阳性。注册申请人应当按照试验对Z-值>3及Z-值<-3的情况分别开展说明。
鉴于并无100%阴阳性分界点,一般来说,注册申请人应设定阳性判断值灰区范围,灰区的设定应提交理论与实际试验结果的依据,并在说明书【阳性判断值】与【检验结果的解释】项开展解释说明,如:是否需要用产前诊断的方式开展最终确认,可能的原因,是否需要孕龄再大时开展再次抽血复测等等。如无灰区设置,也应提交理论与大样本量试验结果的依据。
在阳性判断值设定后,注册申请人应当按照基于一定数量阴、阳性真实临床样本开展试验验证,如与该公式不符,则应说明出现的问题及详细的数据校正方式。
5.其他资料
5.1主要原材料研究资料
主要原材料的研究资料包括企业参考品与完成检测所需试剂组成两部分。
5.1.1企业参考品
应至少包括:准确性参考品、特异性参考品、检测限参考品、重复性参考品,具体要求如下:
5.1.1.1准确性参考品:应按照基于T21、T18、T13胎儿DNA片段按一定比例与正常女性血浆混合的模拟样本。
5.1.1.2特异性参考品:应包括以下样本开展特异性参考品设置。
5.1.1.2.1按照基于染色体数目正常胎儿DNA片段按一定比例与正常女性血浆混合的模拟样本或胎儿核型正常的孕妇血浆。
5.1.1.2.2按照基于其他染色体异常胎儿DNA片段按一定比例与正常女性血浆混合的模拟样本开展评价。
5.1.1.2.3按照基于一定比例的微缺失微重复胎儿DNA与正常女性血浆混合制备微缺失微重复模拟样本开展评价。
5.1.1.2.4按照对产品的质控要求自行设定模拟T21、T18与T13嵌合体的组成比例,如70%异常,30%正常;30%异常,70%正常等。
其他染色体异常、微缺失微重复以及嵌合体特异性参考品由注册申请人依据常见类型并按照对产品的质控要求自行选择。
5.1.1.3检测限参考品:应按照基于T21、T18、T13胎儿DNA片段按不同比例梯度与正常女性血浆混合的模拟样本,如5%、3.5%、2.5%等,建议按照基于95%(n≥20)的阳性检出率作为最低检测限确定的标准。
5.1.1.4重复性参考品:一般包括染色体数目正常阴性重复参考品以及T21、T18、T13弱阳性重复性参考品,其中,阳性重复性参考品可按照基于T21、T18、T13胎儿DNA片段按一定比例与正常女性血浆混合的模拟样本开展制备。
T21、T18、T13及其他染色体异常胎儿DNA片段可由流产组织或羊水细胞、细胞系等来源制备。
注册申请人应详细说明企业参考品的组成、详细说明制备及检定方法、胎儿DNA片段浓度确认方式与所占比例的选择依据。组成各项企业参考品的样本应为不同来源。
5.1.2.完成全部检测流程所需试剂
一般应至少包括:血浆游离DNA提取纯化试剂、文库构建试剂、文库定量试剂、测序试剂、阴性质控品、阳性质控品以及与之配合使用的测序芯片与数据研究软件。具体要求如下:
5.1.2.1血浆游离DNA提取纯化试剂:无论申报产品中是否包括,注册申请人均应提交配合使用的提取纯化试剂的原理、详细组成成分、生产厂家、货号及医疗器械备案凭证编号的相关资料。性能方面需对该试剂提取的DNA片段长度范围准确性、浓度及纯度要求,提取效率、重复性及抗干扰能力开展评估。
5.1.2.2文库构建试剂、文库定量试剂、测序试剂:文库构建试剂对片段化的DNA开展缺口补平及相应部分5’端磷酸化(如需)与3’端去磷酸化(如需),之后使用连接酶加上用于测序与研究的标签与接头,构建成可以用来测序上机的标准文库;文库定量试剂通过聚合酶链反应(Polymerase Chain Reaction,PCR)扩增及与标准品曲线的比对,用于定量测定文库浓度,为后续均一化文库开展上机测序做准备,同时能够评估文库构建的质量。文库定量时应弄清楚对文库质量、片段大小及浓度要求,应提供研究图谱,对其中参数开展解释说明(如是否有杂峰,产生的原因,是否对最终结果产生影响)。文库定量不限于上述方法,也可按照基于其他方法开展,如荧光染料法、Qubit定量等;测序试剂用于对均一化的文库开展片段扩增,通过基因测序仪捕捉扩增过程中碱基的变化引起的信号变化来达到读取序列的目的。
以上三种试剂一般由:相应功能的酶(末端修复酶、DNA连接酶、缺口修复酶DNA聚合酶等)、核苷酸序列(引物、接头序列、标签序列、文库定量标准品)、缓冲液及dNTP组成。具体要求如下:
5.1.2.2.1酶:应提交纯度、活性及功能性试验资料。例如:文库构建过程包括但不限于末端修复酶、DNA连接酶、缺口修复聚合酶等,所选择的酶应当具有末端极大削平、缺口补平、标签或接头连接、DNA聚合酶活性。
5.1.2.2.2核苷酸序列:应提交相应的序列组成与纯度信息,序列准确度;引物设计应提交引物设计原则及选择比较依据,靶向测序技术应提供目标区域覆盖范围。
5.1.2.2.3缓冲液:应弄清楚详细的组成及各盐浓度选择比较的依据。
5.1.2.2.4 dNTP:包括dATP、dGTP、dCTP、dTTP,应提交对纯度、浓度等的详细验证资料。
5.1.2.3阴、阳性质控品:须能够监控DNA片段提取到最终测序结果全过程,因此应当由阴、阳性(T21、T18与T13)胎儿DNA片段按已知比例与正常女性血浆基质混合组成。T21、T18、T13染色体异常胎儿DNA片段可由流产组织或羊水细胞、细胞系等来源制备。
5.1.2.4测序芯片:应详细阐明芯片开展片段扩增的原理及结构,弄清楚使用芯片型号。
5.1.2.5数据研究软件:举例介绍原始数据质量评估、数据处理与筛选的方法,弄清楚数据筛选依据以及使用的算法。
5.1.2.6提交不同原材料对于最终测序数据质量影响的评估材料。因为各测序平台的技术侧重点不同,数据质量评估的项目可能存在差异,需考虑包括但不限于以下方面:文库浓度、文库片段大小、单样本总序列数(数据量)、唯一比对率、单次检测的GC gap(最高GC值与最低GC值的差值)等。
5.1.2.7除上述资料,注册申请人还应提交主要原材料的筛选依据及试验资料。如为自制,则应提交:制备方法、质量要求、质量检测方法、比较筛选的试验资料等;如为外购,则应提交:外购证书、质量要求、质量检测方法、比较筛选的试验资料等。其中,比较筛选的试验资料应包括筛选过程中的数据、图谱、比较图表等信息。
5.2生产工艺研究资料
包括配制工作液、半成品检定、分装与包装。配制工作液的各种原材料及其配比应符合要求,原材料应混合均匀,配制过程应对根本参数开展有效控制。所提交申报资料中应包括主要生产工艺介绍与生产工艺流程图,后者需标注清楚根本工艺质控步骤,并详细说明该步骤的质控方法及质控标准。
(四)临床评价资料
临床试验的开展、方案的制定以及报告的撰写等均应符合相关法规及《体外诊断试剂临床试验技术指导原则》的要求,如相关法规、文件有更新,临床试验应符合更新后的要求。
1.临床试验机构及人员
选择不少于3家(含3家)备案的临床试验机构,按照相关法规与指导原则的要求开展临床试验。临床试验机构应为已取得产前诊断技术服务资质的医疗机构。人员应为经过专门培训的取得资质的人员。机构与人员应遵循《产前诊断技术管理措施》《母婴保健专项技术服务许可及人员资格管理措施》,机构取得《母婴保健技术服务执业许可证》,人员取得《母婴保健技术考核合格证书》或者《医师执业证书》中加注母婴保健技术(产前诊断类)考核合格的。
2.受试者选择与临床样本
临床试验的入组人群应为产品的预期适用人群,即为孕周为12+0周及以上的孕妇。不同年龄段孕妇应按自然比例分布,35岁及以上孕妇占比应控制在15%-20%。
临床样本一般为外周血血浆样本。临床样本的采集、处理、保存与提取等应符合国家卫生健康委员会等相关文件的规定,并满足相关产品说明书的要求。
3.临床试验方法
3.1筛查性能评价
研究方法为前瞻性研究,按照临床试验方案设定的入组标准前瞻性入组受试者。按照基于试验体外诊断试剂与确诊胎儿染色体非整倍体T21、T18、T13的临床参考标准开展比较研究。以介入性产前诊断手术结果(包括绒毛取材术、羊膜腔穿刺术与经皮脐血管穿刺术)与出生随访结果作为确诊胎儿染色体非整倍体T21、T18、T13的临床参考标准。对于出生随访,应在方案中弄清楚随访由产科或新生儿科医护人员开展,各机构在制定方案中对医师开展统一的培训,按照基于科学的、统一的评价标准与评价项目(应当提供依据)对出生后婴儿表观开展是否是三体患儿的诊断,也可按照基于出生后采血开展核型研究的方式开展诊断。
样本量依据统计学及胎儿染色体三体发病率计算,按照其临床预期用于产前筛查的用途,按照发病率计算建议总例数不少于10000例。试验要求能够筛选出一定数量的T21阳性、至少1例的T18阳性与至少1例的T13阳性。如未筛查出符合要求的阳性病例数量,则应继续增加样本例数开展筛查,所有样本均应可以溯源。
选用交叉四格表的形式总结试验体外诊断试剂检测结果与临床参考标准结果,选择合适的统计方法开展统计研究。评价指标主要包括灵敏度、特异度、阳性预测值、阴性预测值等,并计算95%置信区间。
临床试验应严格控制失访率,对于失访数据应说明原因,并确认是否对临床试验造成偏倚。
3.2临床检测性能评价
因为更加充分地评价申报产品的临床检测性能,鉴于筛查性能评价中阳性样本例数较少,可在此基础上进一步开展通过了解性入组,纳入部分已确诊胎儿染色体非整倍体T21、T18、T13的阳性病例,按照基于试验体外诊断试剂与临床参考标准开展比较研究。此部分研究,应在试验方案与报告中对病例选择的方式与原因开展弄清楚的说明。
临床试验应选择合适的统计学模型开展样本量估算,并详细描述所使用统计方法及各参数的确定依据。例如,临床试验的阳性样本与阴性样本的最低样本量,可按照预实验获得的阳性符合率与阴性符合率的预期值按照基于如下公式计算:
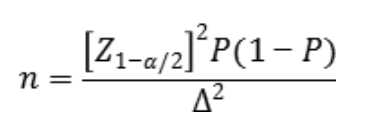
公式中n为样本量,Z1-α/2为置信度标准正态分布的分位数,P为评价指标预期值,Δ为P的允许误差大小。一般取P的95%可信区间宽度的一半,常用的取值为0.05-0.1。
按照临床发病率及其他因素综合考虑,对于胎儿染色体非整倍体T21,其阳性例数应具有统计学意义;对于胎儿染色体非整倍体T18,建议阳性样本例数不少于20例;对于胎儿染色体非整倍体T13,建议阳性样本例数不少于10例。
选用交叉四格表的形式总结可归结成两种方法的定性检测结果,选择合适的统计方法开展统计研究,以验证可归结成两种方法检测结果的一致性。评价指标主要包括阳性符合率与阴性符合率,并计算95%置信区间。对于可归结成两种方法检测结果纷歧致的样本,应对纷歧致的原因开展研究。
4.伦理学要求
临床试验应当遵守《世界医学大会赫尔辛基宣言》的伦理学准则,必须获得伦理委员会的同意。研究者应充分考虑临床试验用样本的获得与试验结果对受试者的风险性,应提交伦理委员会的审查意见。
5.临床试验方案
5.1临床试验实施前,某学说学派应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学可靠的临床试验方案。需遵循如下要点:
5.1.1各临床试验机构应执行统一方案,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。临床试验方案的修改过程与版本要记录在案,且每次改动应记录原因。
5.1.2整个试验过程应在临床试验机构的实验室内并由本实验室的技术人员操作完成,申办者的技术人员除开展必要的技术指导外,不得随意干涉实验进程,尤其是数据收集过程。
5.2临床试验方案还应详细阐述如下内容:
5.2.1临床试验机构选择、临床主要某学说学派简介;对临床试验的整体管理情况、质量控制、试验人员培训、仪器日常维护、仪器校准、质控品运行的规定。
5.2.2临床背景、病例纳入/排除标准、样本的预期选择例数及标准。其中须注意,病例纳入/排除标准应严格制定并实施,任何已经入选的病例再被排除出临床试验都应记录在案并弄清楚说明原因。在试验操作过程中与判定试验结果时应按照基于盲法以保证试验结果的客观性,对于编盲的方式应有详细描述。
5.2.3如按照基于出生随访方式,则应对出生随访的依据、项目及判定标准开展详细规定,包括但不限于如下内容:随访操作及记录人员、复核人员、随访方式、随访项目、判定依据、随访时间周期及间隔、随访终点等。
5.2.4样本类型、样本的收集、处理及保存等。
5.2.5数据预处理、统计学方法、统计软件、评价统计结果的标准。
6.临床试验报告
临床试验报告应该对试验的整体设计及各个根本点给予清晰、完整的阐述,应该对整个临床试验实施过程、结果研究、结论等开展条理分明的描述,并应包括必要的基础数据与统计研究方法,最后得出临床试验结论。临床试验报告的撰写参考《体外诊断试剂临床试验技术指导原则》及关于实施《医疗器械临床试验质量管理规范》密切相关事项的通告附件《体外诊断试剂临床试验报告范本》的相关要求。
6.1样本例数(包括各机构的样本例数、阳性检出例数等)、孕妇年龄分布情况、建议以列表方式给出具体例数及百分比。
6.2对检测精密度、质控品测量值的抽查结果评估。
6.3具体试验过程及试验过程中需要说明的问题,研究过程中是否涉及对方案的修改。
6.4申报试剂批号、有效期及所用机型等信息,配合使用的试剂、耗材及仪器的厂商信息、货号及产品医疗器械注册证编号。需要强调的是:临床试验研究应使用与说明书描述一致的配套使用试剂及仪器。
6.5统计学研究:样本的纳入与排除情况;数据预处理、差异数据的重新检测与否以及最终是否纳入数据统计、对异常值或缺失值的处理。另外考虑到对不同年龄段孕妇样本的阳性检出率可能存在一定差异,故建议对不同年龄段孕妇样本分别开展统计研究。
6.6讨论与结论:对总体结果开展总结性描述并研究试验结果,对本次临床研究有无特别说明,最后得出临床试验结论。
6.7临床试验数据表应包括如下信息:唯一可追溯的样本编号、年龄、临床参考标准具体结果、试验体外诊断试剂检测结果。其中临床参考标准如为核型研究,应弄清楚具体结果;如为出生随访,则应弄清楚胎儿出生时间、随访时间、随访方式、随访结果。全部数据应可溯源。
(五)产品说明书
产品说明书的格式应符合《体外诊断试剂说明书编写指导原则》的要求,进口产品的中文说明书除格式要求外,其内容应尽量保持与原文说明书的一致性,翻译力求准确且符合中文表达习惯。产品说明书的所有内容均应与注册申请人提交的注册申报资料中的相关研究结果保持一致,如某些内容引用自参考文献,则应以规范格式对此内容开展标注,并单独列明参考文献的相关信息。
结合《体外诊断试剂说明书编写指导原则》的要求,下面对说明书的重点内容开展详细说明。
1.【产品名称】
建议按照如下方式命名:胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(方法学)或胎儿染色体非整倍体(T21/T18/T13)检测试剂盒(方法学)。
举例:胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(半导体测序法)、胎儿染色体非整倍体(T21/T18/T13)检测试剂盒(可逆末端终止测序法)、胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(联合探针锚定聚合测序法)。
2.【预期用途】至少应包括以下内容:
2.1该产品用于定性检测孕周为12+0周及以上的孕妇外周血血浆中胎儿游离脱氧核糖核酸,通过研究样本中的胎儿游离DNA的21号、18号及13号染色体数量的差异,对胎儿染色体非整倍体疾病21-三体综合征、18-三体综合征与13-三体综合征开展产前筛查。如试剂盒仅是测序步骤中的建库步骤,则预期用途应描述为“构建测序文库”。
2.2按照《体外诊断试剂说明书编写指导原则》介绍临床适应症及背景,说明相关的临床或实验室诊断方法等,应介绍产前诊断金标准。
2.3弄清楚该产品仅作为21号、18号及13号染色体的产前筛查用途,其结果要由产前诊断金标准开展确认并遵守相关法律法规及行业规范。
3.【检验原理】
详细说明该产品检测母体胎儿游离DNA判断染色体数量的检测原理及方法学原理(必要时可用图示开展)。
4.【主要组成成分】
说明试剂盒所包括组分的名称、数量,必要时弄清楚组分比例、浓度等信息,说明不同批号试剂盒中各组分是否可以互换。
试剂盒中不包括但该项检测必需的组分,说明书中应列出相关试剂/耗材的名称、生产企业、货号、注册证号/医疗器械备案凭证编号(如有)及其他相关信息,测序芯片应弄清楚型号。测序芯片若包括在测序通用试剂中,有单独型号应弄清楚,若无型号应弄清楚芯片具体名称。
5.【储存条件及有效期】
5.1按照稳定性研究资料,说明试剂盒的效期稳定性、开瓶稳定性、复溶稳定性、运输稳定性、冻融次数要求等,应标注清楚具体的储存条件及效期。
5.2按照《医疗器械说明书与标签管理规定》(总局令第5号)增加生产日期,使用期限或者失效日期。
6.【样本要求】
6.1样本采集要求。
6.2说明对采血管及抗凝剂的要求。
6.3样本保存、运输及处理:孕妇外周血样本的保存条件(温度、保质期限)、运输条件、处理条件(如:多长时间内必须分离血浆);已分离的血浆样本的保存条件(温度、保质期限)、运输条件、处理条件(如:核酸提取前的预处理);冷藏/冷冻样本检测前是否需恢复至室温,冻融次数的要求。
上述内容均需在稳定性研究资料中详述并用产品开展性能评估验证。
7.【适用机型】
适用的测序仪器具体型号,并提供与仪器密切相关的重要信息以指导用户操作。
8.【检验方法】
无论是否包括提取试剂或测序试剂,注册申请人应从头详细描述完成完整检测所需的全部步骤以指导用户正确操作,包括血浆游离DNA的提取、文库构建、文库定量及上机测序等。该类产品操作程序较多,作为产品使用说明书该项内容应当尽量详细,以能够指导用户开展操作,其中应当包括各步骤的注意事项及配合使用物品的技术参数、仪器厂家与型号(如PCR仪,生物研究仪等)与反应条件,以半导体测序为例:
8.1 DNA提取:DNA提取方式、提取试剂盒货号及医疗器械备案凭证编号;DNA提取液的短期与长期保存方式、冻融次数等。
8.2文库构建:末端修复、接头连接、缺口修复、PCR扩增;所构建的文库短期与长期保存方式,冻融次数等。
8.3文库定量;描述对于定量后文库浓度与质量的要求,以及何种情况开展文库的重新构建。
8.4测序模板的制备:混合文库、PCR、模板富集。
8.5上机测序:仪器准备、设置及仪器使用相关参数。
8.6说明文库浓度、有效数据量以及样本结果的质控要求等。
9.【阳性判断值】
弄清楚设定阳性判断值所使用的算法及验证参考值所使用的样本例数及类型。如使用软件,则应弄清楚软件名称、软件发布版本号、生产厂家及医疗器械注册证书编号;如暂未取得医疗器械注册证书,应空出相应内容,在软件名称后注明(医疗器械注册证书编号:)。
10.【检验方法的局限性】
10.1 本试剂盒作为胎儿染色体非整倍体筛查检测,其结果仅供临床参考,不能作为诊断的唯一依据。对患者的临床诊断应按照基于金标准方法(染色体核型研究)并结合其症状/体征、病史及其他实验室检查等情况综合开展。本试剂盒不能对胎儿染色体结构异常开展检测。
10.2 本试剂盒适用于孕妇外周血血浆样本检测,不适用于其它样本检测。
10.3 胎儿游离DNA浓度在孕妇外周血中存在较大个体差异,变化范围从2%到30%不等且与孕周密切相关,因此若因胎儿游离DNA浓度较低造成检验失败时,可待孕周较大时再次抽血检测。
10.4以下几种情况的孕妇样品可能会出现假阳性或假阴性结果,需要结合其他检测结果开展综合判断:
10.4.1孕妇本人为染色体非整倍体疾病患者、其他染色体疾病患者或携带者;
10.4.2胎儿染色体异常中的平衡易位、嵌合型三体异常;
10.4.3怀有双胎或者多胎(三胎及三胎以上)的孕妇;
10.4.4近期接受过移植手术、干细胞治疗;近期接受过免疫治疗或输注过异体血制品;
10.4.5孕妇本人为肿瘤患者;
10.4.6通过体外受精—胚胎移植(IVF-ET)方式受孕的孕妇;
10.4.7体重严重超重的孕妇。
10.5样本采集、运输及处理不当、未按说明书操作均有可能结果假阳性或假阴性结果;描述在样本采集,保存、运输中需遵循的原则及注意事项,例如:
10.5.1描述适用的抗凝采血管;
10.5.2颠倒混匀时动作应轻柔,防止溶血;
10.5.3全血离体后须开展血浆分离的时间;
10.5.4血浆分离过程中注意不要吸到中间层的白细胞;
10.5.5血浆样本是否能够开展反复冻融;
10.5.6禁止将XX抗凝样本与血浆样本在室温状态下放置;
10.5.7血浆样本寄送按照基于的运输保存方式。
10.6 其他局限性。
11.【产品性能指标】
按照研究性能评估资料内容详述以下性能指标:最低检出限、企业内部参考品符合率、精密度、干扰试验、特异性。各项评估应包括评估方法、数据与结果。应将临床评价的试验结果纳入,包括临床试验机构数量、样本例数、试验结果等内容。
(六)质量管理体系文件
注册申请人应当在申请注册时提交与产品研制、生产密切相关的质量管理体系相关资料。详述产品的生产过程,提供生产工艺流程图。弄清楚申报产品反应及检测原理与过程,标注清楚主要控制点与项目及主要原材料、采购件的来源及质量控制方法。
如适用,应当提供拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的比较说明。
三、参考文献
[1]《产前诊断技术管理措施》(国家卫生健康委员会令第2号),2019年2月28日。
[2]《孕妇外周血胎儿游离DNA产前筛查与诊断技术规范》,2016年11月9日。
[3]Cell-free DNA Screening for Fetal Aneuploidy,ACOG, 2015.
[4]Noninvasive prenatal screening for fetal aneuploidy, 2016 update, ACMG, 2016.
[5]Position Statement from the Chromosome Abnormality Screening Committee on Behalf of the Board of the international Society for Prenatal Diagnosis, ISPD, 2015.
[6]Guidelines for diagnostic next-generation sequencing, guidelines for the evaluation and validation, EuroGentest and the European Society of Human Genetics, 2016.
[7]Use of Standards in FDA Regulatory Oversight of Next Generation Sequencing (NGS)-Based In Vitro Diagnostics (IVDs) Used for Diagnosing Germline Diseases, Draft Guidance for Stakeholders and Food and Drug Administration Staff, FDA, 2016.
[8]《出生缺陷防治报告》,中华人民共与国卫生部,2012。



 1135
1135

