
本指导原则旨在指导注册申请人对ABO、RhD血型抗原检测卡(柱凝集法)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对ABO、RhD血型抗原检测卡(柱凝集法)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。如申请人认为有必要增加本指导原则不包括的研究内容,可自行补充。
本指导原则是对申请人与审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,要是有能够满足相关法规要求的其他方法,也可以按照基于,但需要提供详细的研究资料与验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规与标准体系以及当前认知水平下制定的,随着法规与标准的不断改进,以及科学技术的不断发展,本指导原则相关内容也将适时开展调整。
本指导原则针对相关产品注册申报资料中的部分内容开展撰写,其他未尽事宜应当符合相关法规要求。
一、适用范围
ABO、RhD血型抗原检测卡(柱凝集法)即使用葡聚糖凝胶、玻璃微珠等材料开展填充微柱,以免疫血液学、颗粒过筛与离心技术结合原理,开展人静脉全血ABO血型的正定型鉴定及RhD抗原的检测,不适用于ABO亚型与RhD变异型的鉴定确认。
本指导原则适用于ABO、RhD血型抗原检测卡(柱凝集法)以及包括ABO、RhD血型抗原检测用途的柱凝集法的血型检测卡,但不适用于血源筛查用血型正定型试剂。
对于新生儿专用的血型抗原检测卡,可能部分要求不完全适用或本文所述内容不够全面;申请人可参考本指导原则,同时依据产品特性对适用部分开展评价,对不适用部分阐述不适用的理由,并验证替代方法的科学可靠性。
二、注册审查要点
(一)综述资料
综述资料的撰写应符合《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告》(国家药品监督管理局公告2021年第122号)的相关要求。其中,包装描述建议提交外包装与检测卡的实物图片。与同类与/或前代产品的比较部分应着重从抗体类型、抗体生物学来源、特异性、灵敏度、有效期等方面写明拟申报产品与目前市场上已获批准的同类产品之间的异同。预期用途部分应重点弄清楚具体的预期用途与适用人群,对于适用人群包括新生儿的情况,应开展弄清楚。
对于未包括在试剂盒中的试剂,如红细胞稀释液等,需提交注册信息与说明书。提供配套使用仪器的注册信息(注册证/国家药监局数据查询系统上的注册信息截图)。
(二)主要原材料研究资料
主要原材料研究资料应包括主要组成成分(抗体、凝胶或其他填充物、缓冲液等)的选择、制备及其质量标准的研究资料。
1.抗体的选择及质量标准。依据研发设计资料,详细描述抗体的筛选过程。应弄清楚写明筛选过程中各原材料抗体的生产商、生物学来源、克隆号与抗体类型(IgG/IgM)。抗A与抗B抗体多为IgM型抗体,抗D抗体应弄清楚抗体属性,是IgM型或IgG型或两者均含有。
(1)抗体效价
将抗A、抗B、抗D抗体开展倍比稀释,应用试管法分别与A1型、A2型红细胞试剂,B型红细胞试剂与正常RhD阳性试剂红细胞(正常RhD阳性试剂红细胞,即不包括RhD抗原变异体在内的RhD阳性红细胞)试剂反应,考察抗体效价,提交可接受原材料抗体效价范围的研究资料。
建议境内产品在符合产品研发时设定接受标准之外,与抗A抗B血型定型试剂效价测定用国家参考品与抗D(IgM)血型定型试剂效价测定用国家参考品比对,抗体效价不得低于国家标准品。
进口产品依据原产国适用标准、标准品或原材料内部标准品提交效价研究资料,并详细阐述原产国适用标准、标准品或原材料内部标准品的制备标定过程。
(2)特异性
抗A抗体应与A1型、A2型红细胞与A1B、A2B型红细胞出现阳性反应,与B型、O型红细胞为阴性反应。抗B抗体应与B型红细胞及A1B、A2B型红细胞出现阳性反应,与A1型、A2型、O型红细胞为阴性反应。抗D抗体应与RhD阳性红细胞出现阳性反应,与RhD阴性红细胞为阴性反应。
所有阳性反应不应有双群现象等混合反应,所有阴性反应不应有凝集、溶血等不易分辨现象(注:阴性反应的不易分辨现象包括柱内肉眼可见的红细胞拖尾。)。
(3)抗体亲与力
抗A、抗B抗体亲与力应该满足现行《中华人民共与国药典》要求。将抗A、抗B抗体分别与10%红细胞悬液于瓷板或玻片上混匀,抗A抗体与A1、A2、A2B血型红细胞出现凝集的时间应分别不长于15秒、30秒、45秒;抗B抗体与B血型红细胞出现凝集的时间应不长于15秒,且在3分钟内凝集块应达到1mm2以上。
抗D抗体亲与力可参考相应的行业标准。将约50μL抗体置洁净瓷板或玻片上,加等体积10%RhD阳性O型红细胞悬液(3人份混合),立即混匀,凝集时间应不相较而言更多15s,3min内凝集块应不小于1mm2。
(4)应提供至少三个不同批次抗体的验证资料。
(5)如为两株抗体混合,应提交验证资料说明混合比例。
2.填充物的选择
说明填充物如凝胶、玻璃珠的特性,如组成、粒径及其质量控制要求。应提交选择比较过程,提交验证试验资料。
3.详述各主要原材料来料检验的性能指标与检验方法,提交原材料CoA与入厂检验报告。
(三)主要生产工艺及反应体系的研究资料
1.主要生产工艺概述,可用流程图方式表示。
2.主要生产工艺过程的研究资料、每一步生产工艺的确认资料及试验数据。
考虑到不同厂家凝胶柱形状设计不同,申请人应当提供凝胶卡柱的真实照片,阐述设计原理与作用,并详述卡柱每部分的功能。
弄清楚填充缓冲液的具体组成成分与pH值,弄清楚各组分的功能与效用。若含有增强抗原抗体反应的缓冲液成分,应详细说明,并提交研究资料阐述其对弱抗原检出及血型判定的影响。
抗体效价的选择确定过程、凝胶溶胀条件(如介质、时间、温度等)的确定、填充量及填充过程的研究资料(填充应确保均匀无气泡)与质量控制标准(凝胶高度,试剂液体高度)。
目前此类产品存在人工灌装、半自动与自动生产线多种批量生产模式,申请人应当详述所选用生产模式中的配制过程、灌装过程、成品检测与放行及各个环节的质量控制指标与检验方法。
3.主要反应体系的研究资料、每一步反应体系的确认资料及试验数据。
反应体系的设置应符合《全国临床检验操作规程》等公认标准操作规范、指南或标准的要求并提供验证资料。
(1)详述样本的采集与处理过程,包括正常样本与干扰样本(如血清蛋白异常增高样本);详述红细胞悬液的制备要求及红细胞浓度的确定过程。红细胞稀释液建议优先使用生理盐水,如使用配套稀释液,应弄清楚说明使用稀释液替代生理盐水的理由,详细说明稀释液成分并提供充分验证资料。
(2)反应条件研究,包括红细胞悬液用量、离心条件、反应程序、温度与时间等。
对于此类产品,合适的离心条件(离心时间、速度与角度)很重要,直接影响凝集强度与检测结果判定。因此,离心条件研究中,凝胶卡配套全自动血型研究仪或离心机的型号应当固定。在此前提下,提交每个适用仪器的离心程序(离心力、离心时间与升降速等)研究。
(3)反应结果的判断时间。当反应结束后,检测结果的判读时间范围。若反应结束后无法即刻开展结果判读,反应卡的保存条件与保存稳定性。
反应体系设置与《全国临床检验操作规程》要求纷歧致的产品应提供充分的每一步反应体系的研究确认资料与验证数据证明反应体系的有效性。
(四)研究性能评估资料
注册申请人应按照基于在符合质量管理体系的环境下生产的试剂盒开展所有研究性能研究。对于每项研究性能的评价都应包括具体研究目的、实验设计、研究方法、可接受标准、实验数据、统计方法等详细资料。密切相关研究性能验证的背景信息也应在申报资料中有所体现,包括实验地点(实验室)、适用仪器、试剂规格、批号、临床样本来源等。研究性能评估的实验方法可以参考国内或国际密切相关体外诊断产品性能评估的指导原则开展。
产品性能研究所按照基于的仪器、试剂或其他物品如可能均应按照基于境内或境外已批准上市的产品,如红细胞试剂、抗人球蛋白试剂、离心机等。
研究性能评估试验中应弄清楚所有试验每种试剂的用量、红细胞的浓度、按照基于的试验方法。所有试验方法应符合产品说明书的具体操作要求。
研究性能研究应按照基于至少三批产品开展。如检测卡同时适用于手工法及全自动血型研究仪,应分别开展性能验证并对两者性能开展比较。对于不同的全自动血型研究仪,应分别开展方法学比对研究与精密度研究。
建议着重对以下研究性能开展研究:
1.外观
检测卡应标识清晰,不同抗体对应不同颜色。封口应严密且能够整条撕脱。检测卡内填充物均匀,无干枯现象。内填充物表面上应有液体层,各柱填充物及液体中不应有杂质,液面高度一致,无显著倾斜,离心后应无气泡。
2.适用的样本类型、抗凝剂与样本稳定性
样本类型为人静脉全血。
不同的抗凝剂与不同保存时长的样本会影响凝集强度,因此申请人应当详述抗凝剂选择依据,提交抗凝剂适用性研究;提交每种适用抗凝剂下,不同保存时长的样本对检测结果影响的研究资料。
3.临床样本验证
(1)方法学比对。收集各ABO血型临床样本,包括RhD阴性样本,按照基于试剂卡开展检测,将血型鉴定与凝集强度结果与已上市试剂结果开展比较。临床样本的收集应考虑涵盖肿瘤、血液病、自身免疫病与贫血患者、老人、儿童及新生儿等来源。
(2)收集临床ABO弱凝集(阳性小于3+)与ABO正反定型纷歧致的红细胞样本,申报产品应该可以通过凝集强度与反定型结果区分主要表型与弱/不凝集的ABO亚型(A1与A2除外)。提供各种凝集强度的图片。
(3)收集各种血型的直接抗人球蛋白试验阳性红细胞开展检测验证,并提供直接抗人球蛋白试验试剂及检测结果信息。
(4)收集弱D、部分D与DEL表型红细胞(阳性小于3+),申报产品应该可以通过凝集强度区分正常表达D抗原与弱D、部分D与DEL表型等变异体。弄清楚RhD变异体的具体确定方法。
(5)溶血、脂血、黄疸等样本的干扰评价。
临床样本的检测结果应符合以下要求:
(1).特异性
抗A柱应与A1型、A2型红细胞与A1B、A2B型红细胞出现阳性反应,与B型、O型红细胞为阴性反应;
抗B柱应与B型红细胞与A1B、A2B型红细胞出现阳性反应,与A1型、A2型、O型红细胞为阴性反应;
抗D柱应与RhD阳性红细胞出现阳性反应,与RhD阴性红细胞为阴性反应。
质控柱(Ctl柱)(如有)均呈阴性反应。
(2)灵敏度即凝集强度要求
抗A柱与A1型红细胞出现凝集反应时,反应强度应为4+,与A2型及A2B红细胞出现凝集反应时,反应强度应不小于3+;与A1B红细胞出现凝集反应时,反应强度应不小于3+;
抗B柱与B型红细胞出现凝集反应时,反应强度应为4+,与AB型(A1B或A2B)红细胞出现凝集反应时,反应强度应不小于3+;
抗D柱与正常RhD阳性红细胞出现凝集反应时,反应强度应不小于3+。
(3)针对阳性反应双群现象等混合反应,阴性反应溶血等不易分辨现象,提交结果图,并解释出现原因。
4.与试管法的比对试验
按照基于仍然的A1型、A2型、AB型、B型、RhD阳性红细胞,将试剂卡检测结果与试剂卡使用的抗体按照基于试管法的检测结果开展比较,依据各自的结果判定方法开展凝集强度的判读,试剂卡凝集强度不得低于试管法。
所有阳性反应不应有双群现象等混合反应,所有阴性反应不应有凝集、溶血等不易分辨现象。
5.精密度
按照基于A1型、A2型、B型、AB型、O型红细胞分别对抗A柱与抗B柱开展精密度研究,按照基于RhD阳性与阴性红细胞对抗D柱开展精密度研究,使用上述所有红细胞对Ctl柱(如有)开展精密度。
精密度研究包括重复性、中间精密度与再现性。建议申请人在设计精密度研究方案时将重复性、中间精密度与再现性精密度研究开展组合研究。组合研究的总体研究时长不少于20天,至少在3个不同的实验室开展,不同的实验室按照基于不同的操作人员,不同实验室所用仪器可为同一型号不同序列号或不同型号。整个研究至少包括3个试剂批次,每个试剂批次与每种适用仪器至少在不连续的5天中使用,每天建议包括上午与下午两个检测轮次,每检测轮次建议设置多次重复。
研究结束后对每个样本的重复性精密度、批间差、中间精密度与再现性精密度开展统计研究。检测结果应分别对应一致,对同一红细胞的检测结果凝集强度差异不超过1+。阴性结果不应有凝集、溶血等不易分辨现象。
手工法检测还应考察不同操作人员之间的重复性。建议由至少3名不同操作人员,按照基于同一批次检测卡重复检测上述红细胞,重复次数不少于10次,比较不同操作人员检测之间的检测结果的重复性。
(五)阳性判断值
以文字结合图示的方式描述不同凝集强度的结果与溶血、混合视野双群等情况,弄清楚不同凝集强度与凝集结果代表的具体意义。
(六)稳定性研究资料
参考体外诊断试剂稳定性研究注册审查指导原则(2025年第4号)的相关要求。
(七)临床评价资料
临床试验总体要求及临床试验资料的内容应符合《体外诊断试剂注册与备案管理措施》、《医疗器械临床试验质量管理规范》、《体外诊断试剂临床试验技术指导原则》、《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告(2021年第122号)》等相关文件的规定,如相关法规、文件有更新,临床试验应符合更新后的要求。以下仅结合ABO、RhD血型抗原检测卡的具体特点对其临床试验中应重点关注的内容开展阐述。
1.临床试验机构的选择
应选择不少于3家(含3家)备案的临床试验机构,按照相关法规与指导原则的要求开展临床试验。不得选择血站开展临床试验。
2.研究方法
建议选择境内已批准上市的同类产品或试管法作为比较方法,按照基于试验体外诊断试剂与之开展比较研究试验,证明试验体外诊断试剂与已上市产品或试管法检测结果的一致性。已上市产品在预期用途、适用人群、样本类型、检测性能等方面应与试验体外诊断试剂具有较好的可比性。
3.受试者选择及样本量要求
入组受试者应来自临床需要开展血型鉴定的患者。建议按照试验体外诊断试剂预期临床性能水平,按照基于单组目标值法公式对总样本例数开展估算:
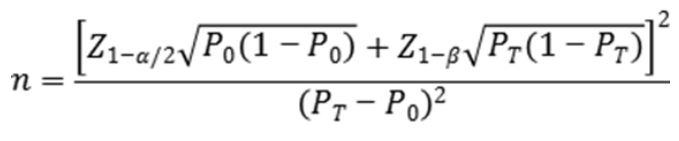
公式中,n为总样本例数;Z1-α/2、Z1-β为显著性水平与驾驭度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为试验体外诊断试剂评价指标预期值。
按照此类产品临床需求与已报道的研究数据,建议总符合率目标值(P0)不低于99.7%。按照同类产品性能水平估算,建议总例数不少于3000例。其中不同血型样本例数应符合中国人群ABO血型分布规律。
临床试验应纳入对于血型鉴定易产生干扰的病例,包括各种疾病患者(如肿瘤患者、自身免疫病患者、血液病患者等)、老人、孕妇、儿童(不同年龄段)、新生儿等。血型分布尽量均衡,ABO血型每种均应有统计学意义,RhD阴性样本建议不少于50例。建议肿瘤疾病患者、自身免疫病患者与血液病患者分别不少于100例,新生儿不少于100例,弱凝集病例不少于15例。
如申报产品能检出弱D与/或部分D,应入组一定例数的样本开展评价。
4.试验过程
分别按照基于试验体外诊断试剂与比较方法依据各自的说明书对入组临床样本开展血型检测,记录结果应具体到凝集强度。
5.统计学研究
建议按照基于R×C表格总结比较试验结果,分别计算A、B、AB、O、RhD血型的符合率与总符合率,并计算符合率的95%置信区间。
6.结果差异样本的验证
对于试验体外诊断试剂与比较方法定型结果纷歧致的样本,应按照基于合适的方法开展样本血型的最终确认。同时,建议按照基于R×C表格对试验体外诊断试剂与比较方法检测A抗原、B抗原、D抗原的凝集强度开展总结。对于凝集强度差异2+或2+以上的样本,建议结合受试者最终的血型鉴定结果或第三方同类试剂的检测结果等开展综合研究。对于临床样本中凝集强度小于3+的样本,应开展进一步确认,弄清楚出现弱凝集的原因。如临床样本检测中出现双群现象,应开展进一步确认,弄清楚出现双群现象的原因。
7.临床试验数据表应作为临床试验小结附件提交。临床试验数据表应列明所有病例的具体临床诊断信息、凝集强度与血型定型结果,如有不符样本应列明第三方确认的结果。申请人应按照法规要求提交数据库。
8.临床试验中应注意试验体外诊断试剂与比较试剂应严格遵守说明书操作要求,如红细胞悬液浓度、离心条件等,应与说明书一致。
(八)产品风险研究资料
风险研究中应充分考虑到各种可能影响检测结果的因素,如某些样本(如新生儿、肿瘤患者、自身免疫病患者、血液病患者等)在开展血型定型检测时可能存在一定的干扰、抗体效价随放置时间延长的减弱对结果的影响、样本放置的影响等,申请人应按照这些不确定的因素研究产品应用可能存在的风险。
(九)产品技术要求
产品技术要求的性能指标应至少包括外观、凝胶柱中的凝胶高度、液体高度、灵敏度、特异性、重复性。
产品技术要求的附录应包括主要原材料与生产工艺。主要原材料应弄清楚抗体来源、抗体类型(IgM/IgG)、克隆号、可接受效价范围、特异性以及功能性验证要求,应弄清楚填充物来源及主要特征(如凝胶的粒径大小等)、质量控制要求;主要生产工艺应以流程图形式描述主要生产工艺过程,并弄清楚主要生产工艺的具体条件与质量控制点。
主要原材料附录部分抗体质量控制标准的书写应为实际的原材料接收标准。此类产品的抗体效价接受标准远高于抗A抗B血型定型试剂效价测定用国家参考品与抗D(IgM)血型定型试剂效价测定用国家参考品的要求。而抗体效价的质量控制对于每批产品的性能根本,因此在书写抗体效价的可接受范围时弄清楚实际的原材料接受标准,而不能单单描述为满足国家标准品效价。
(十)产品说明书
产品说明书的编写参考《体外诊断试剂说明书编写指导原则(2023年修订版)》。以下内容仅对ABO、RhD血型抗原检测卡说明书的重点内容开展详细说明。
1.【预期用途】
(1)写明本试剂按照基于人静脉全血样本开展人ABO血型的正定型检测及RhD血型抗原的检测,同时弄清楚不用于血源筛查,仅用于临床检验。
(2)说明与预期用途相关的临床适应症背景情况,说明相关的临床或实验室诊断方法。
2.【主要组成成分】
(1)依次描述反应卡中各反应柱中的名称与具体的组成成分。其中抗体的描述包括抗体类型(IgM/IgG)、单克隆与克隆号。
(2)弄清楚各组分中缓冲液的具体成分与pH值。
(3)弄清楚需要但未提供的试剂名称、货号与备案号/注册证号。
3.【样本要求】
弄清楚样本采集、红细胞制备与浓度要求,弄清楚配套红细胞稀释液及其备案号。说明溶血、脂血、黄疸样本是否可以使用,或提供使用此类样本的最低要求。依据稳定性研究结果写明样本稳定性要求,弄清楚抗凝剂要求。
4.【适用仪器】
写明适用的离心机型号及全自动血型研究仪型号。
5.【阳性判断值】
弄清楚结果判断方法及标准,并通过不同凝集强度的图例或照片开展详细解释。
6.【检验方法】
写明具体方法及操作步骤
弄清楚检验结果的判断时间范围,以及无法即刻判读时的保存条件与保存稳定性。
弄清楚质控要求:应按照相关规定开展每日质控试验。
7.【检验方法的局限性】
此检验方法的局限性部可能包括以下部分内容,申请人应当依据产品特性开展局限性描述:
(1)弄清楚检测系统(离心机/全自动血型研究仪与红细胞稀释液等)固定搭配使用。
(2)弄清楚红细胞的新鲜程度可能会影响检测结果。
(3)红细胞卷曲造成假阳性的情况。
(4)检测弱A/B抗原与弱D抗原能力的说明。
(5)纤维蛋白对检测结果的影响。
(6)特殊人群如新生儿、老人与免疫力低下人群的检出情况。
(7)被检标本染菌可能造成假阳性结果。
(8)实验室温度低可能结果凝胶颗粒活动性减少,单个红细胞穿过困难,从而结果假阳性结果。
(9)使用陈旧样本可能因细胞破碎,细胞膜浮于胶中或胶面呈弱阳性反应。
(10)对检测结果凝集强度小于3+的情况应如何开展后续处理开展详细说明。
8.【注意事项】
依据产品特性开展注意事项的描述。
(1)检测卡在使用前应离心,并小心解开封口膜,避免迸溅。
(2)强调红细胞悬液浓度范围,不得过高或过低。
(3)微柱中出现溶血情况的处理。
(4)样本离心时间与离心力应严格按照说明书要求操作。
(5)其他。
三、编写单位
国家药品监督管理局医疗器械技术审评中心。
四、参考文献
[1]国家市场监督管理总局.体外诊断试剂注册与备案管理措施:国家市场监督管理总局令第48号[Z].
[2]国家市场监督管理总局.关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告:国家药品监督管理局公告2021年第122号[Z].
[3]国家药品监督管理局.医疗器械产品技术要求编写指导原则:国家药监局公告2022年第8号[Z].
[4]国家药品监督管理局.体外诊断试剂临床试验技术指导原则:国家药监局通告2021年第72号[Z].
[5]国家药品监督管理局.体外诊断试剂说明书编写指导原则:国家药品监管局通告2024年第1号[Z].


 1086
1086

