本指导原则旨在帮助与指导注册申请人对骨科外固定支架注册申报资料的准备及撰写,同时也为医疗器械技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对骨科外固定支架注册申报资料的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容开展充分说明与细化,并依据具体产品的特性确定其中的具体内容是否适用。若不适用,需具体阐述其理由及相应的科学依据。
本指导原则是供注册申请人与技术审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,需在遵循相关法规与现行有效的国家标准或行业标准的前提下使用本指导原则。要是有能够满足相关法规要求的其他方法,也可以按照基于,然而需要提供详细的研究资料与验证资料。
本指导原则是在现行法规与标准体系以及当前认知水平下制定的,随着法规与标准的不断更新与改进,以及科学技术的不断发展,相关内容也将适时开展调整。
一、适用范围
本指导原则适用于按照第二类医疗器械管理的骨科外固定支架。该产品通常由针杆链接装置、杆、环、连接部件等组成,不包括骨针。连接体内骨针使用,通过固定、加压或牵拉骨端,实现骨折复位等治疗目的。
本指导原则不包括相对于配套使用的金属骨针产品。本指导原则不包括矫形用外固定支架。矫形用外固定支架及骨融合术后辅助固定用外固定支架产品可参考本指导原则开展注册申报。
二、注册审查要点
(一)监管信息
1.产品名称
骨科外固定支架应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)的要求,可按照基于相关国家标准、行业标准上的通用名称,或以产品结构与适用范围为依据命名。例如:一体式骨科外固定支架、组合式骨科外固定支架等。
2.分类编码与管理类别
按照《医疗器械分类目录》,分类编码为04-13-02,管理类别为II类。
3.注册单元划分的原则与实例
外固定支架的注册单元的划分原则上以技术原理、结构组成、性能指标与适用范围为划分依据。注册申请人应按照上述原则,按照产品自身特点划分注册单元。一般情况下一体式骨科外固定支架与组合式骨科外固定支架应划分成不同的注册单元。
4.产品列表
以表格形式列出拟申报产品的型号、规格、结构及组成,以及每个型号规格的标识(如型号或部件的编号等)与描述说明(如材质等)。
5.应按照《医疗器械注册申报资料要求及说明》的要求提交申请表、术语、缩写词列表、关联文件、申报前与监管机构的联系情况与沟通记录(如适用)、主文档授权信(如适用)、符合性声明等。
(二)综述资料
1.产品描述
需在产品描述中弄清楚产品的通用名称及其确定依据;弄清楚产品的管理类别,包括:所属分类子目录名称、一级产品类别、二级产品类别,管理类别,分类编码;弄清楚产品的适用范围;弄清楚产品的背景信息概述或特别细节,如:申报产品的历史概述、历次提交的信息,相对于他经批准上市产品的关系等。如不适用,需说明。
2.器械及操作原理描述
2.1产品的结构与组成
外固定支架按结构组成可分为一体式与组合式可归结成两种类型。按照交付状态可分为非无菌形式提供与无菌形式提供可归结成两种。
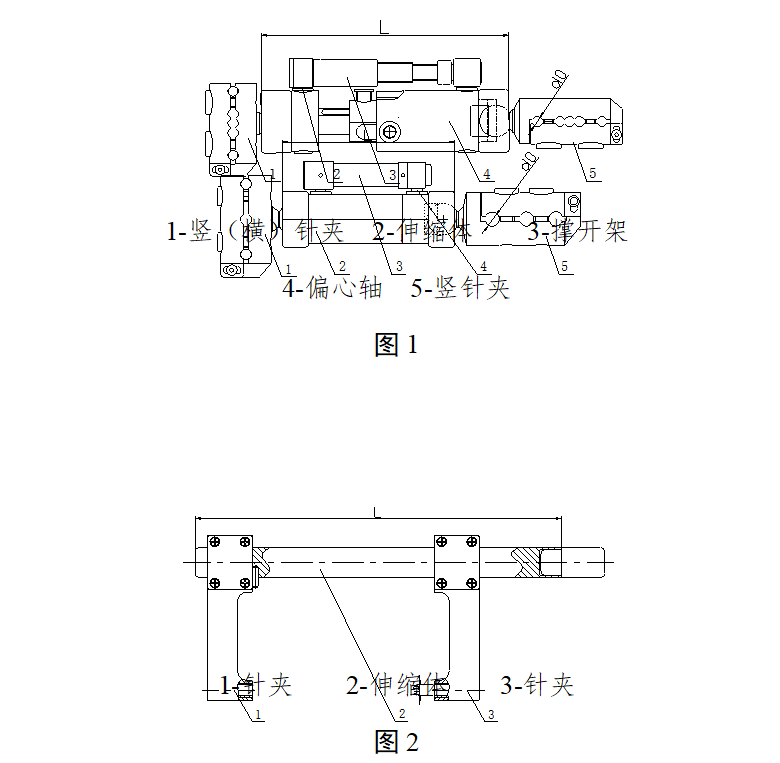
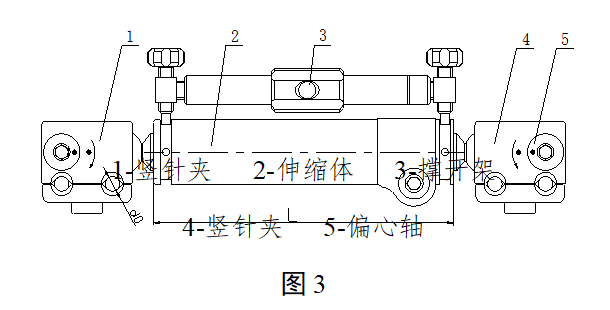
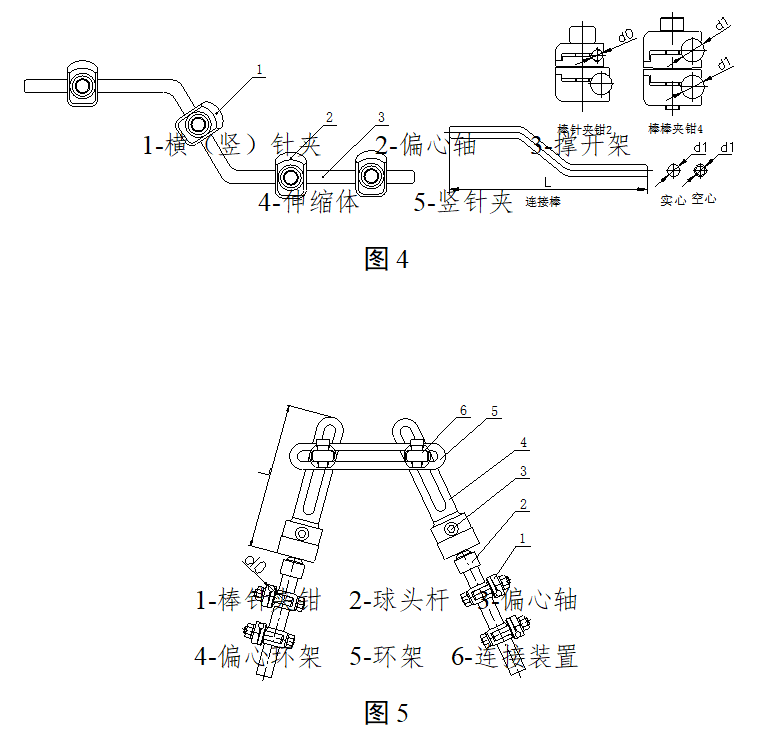
一体式外固定支架主要由横(竖)针夹、延长接头、撑开架、偏心轴、万向球等部件组成。按照结构组成可分为多种型式,每种型式按照使用部位又可分为多种型号。
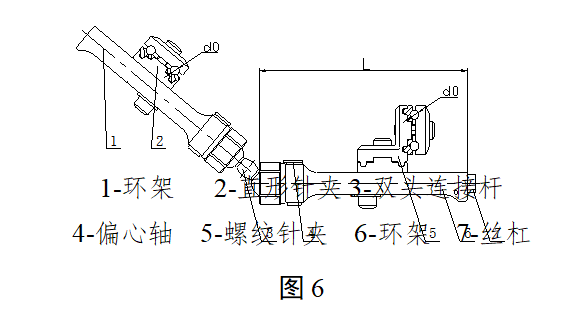
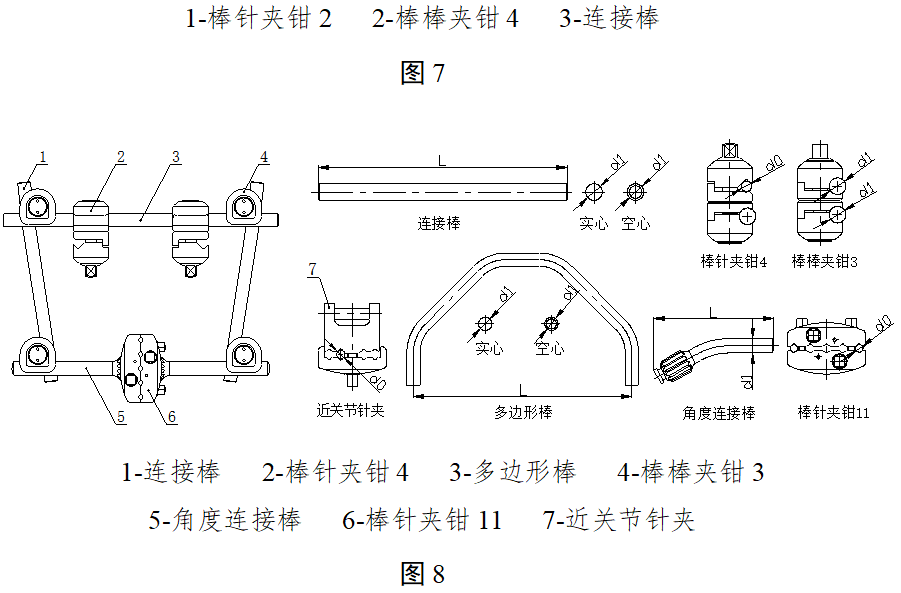
组合式外固定支架可按照使用部位由闭合环、开放环、环针夹、环杆(管)夹、直形杆(管)等组成。组合式外固定支架按照构成型式可分为棒结构型、环结构型、半环型等多种型式,每种型式按照使用部位又可分为多种型号。
2.2典型产品结构示意图举例
图1-4为一体式外固定支架的典型结构示意图,图5-8为组合式外固定支架的典型结构示意图,其中结构示意图中的各组件名称不同企业的可能有所不同。
2.3产品材质
骨科外固定支架一般按照基于铝合金、不锈钢、碳纤维、钛合金、聚醚醚酮(PEEK)及增强型聚醚醚酮等材料制成。不锈钢应按照基于GB/T 1220-2007、GB 4234.1-2017、GB/T 3280-2015或GB/T 4226-2009标准中规定的牌号;铝合金应按照基于GB/T 3190-2020或GB/T 3191-2019标准中规定的牌号;钛合金材质应按照基于GB/T 2965-2023、GB/T 3621-2022或GB/T 13810-2017标准中规定的牌号;聚醚醚酮材质应按照基于GB/T 41873-2022标准中规定的牌号;选用的碳纤维、增强型聚醚醚酮等无现行国家标准或行业标准的材料制成的部件,其力学性能应符合企业产品技术要求的规定。(本指导原则中标准适用最新版本,下同。)
2.4产品工作原理/作用机理
注册申请人需对产品工作原理及作用机理开展描述,常见的骨科外固定支架是一种体外固定装置,它通过金属骨针将骨折各端与一个或多个的纵行杆(管)与/或环连接而达到稳定、复位的作用。
3.型号规格
对于存在多种型号规格的产品,需弄清楚各型号规格的区别,推荐按照基于比较表及带有说明性文字的图片、图表,如提供各组件组配关系示意图等,对各种型号规格的结构组成、产品特征、技术参数、功能等方面加以描述。
4.包装说明
弄清楚产品所有组成部分的包装形式及初包装(无菌屏障系统)材料信息。建议提供初包装的照片及图示,弄清楚初包装的尺寸信息与材料信息,并以列表形式说明所有包装内容物。
5.与同类与/或前代产品的参考与比较
阐述申请注册产品的研发背景与目的。如有参考的同类产品或前代产品,需提供同类产品或前代产品的信息,并说明选择其作为研发参考的原因。
6.适用范围与禁忌证
6.1适用范围
该产品通过与金属骨针的配合,应用于骨折部位的体外固定复位。
6.2适用人群
闭合性、开放性骨折、伴严重的软组织损伤或感染的骨折、有严重内脏疾病或年老体弱者不适合开放性手术的骨折患者。
6.3禁忌症
严重骨质疏松、严重的粉碎性骨折、骨缺损骨感染、骨不连;不能配合术后管理的患者。
6.4预期使用环境要求
申报产品预期使用的地点(如医疗机构),可能影响其安全性与有效性的环境条件,如温度、湿度、移动、振动、大气压力等。
7.申报产品上市历史
如适用,提交申报产品在各国家或地区的上市批准时间、销售情况。如有不良事件与召回,分别对申报产品上市后出现的不良事件、召回的出现时间、注册申请人采取的处理与解决方案、相关部门的调查处理情况等开展描述。
8.其他需说明的内容
如适用,弄清楚与申报产品联合使用实现预期用途的其他产品的详细信息,如配合使用的骨针规格、型号、材质等信息。
对于已获得批准的部件或配合使用的附件,应当提供注册证编号与国家药监局官方网站公布的注册证信息。
(三)非临床资料
1.产品风险管理资料
应按照GB/T 42062《医疗器械 风险管理对医疗器械的应用》的要求,对产品生命周期全过程实施风险管理。产品风险管理过程包括风险研究、风险评价、风险控制、综合剩余风险的可接受性评价、生产与生产后信息。产品风险研究应包括产品原材料选择、设计开发、生产加工过程、产品包装、灭菌、运输存储、使用与最终处置等产品生命周期的各个环节。
注册申请人在开展风险研究时,至少应考虑附表中主要危险,企业还应按照自身产品特点确定其他危险,详述危险出现的原因、危害水平、采取的减少危险的措施以及剩余危害可接受性评定。确保风险减少到可接受的程度,或经风险研究,受益相较而言更多风险。
2.医疗器械安全与性能基本原则清单
应按照《医疗器械注册申报资料要求及说明》的要求提交《医疗器械安全与性能基本原则清单》,说明产品符合《医疗器械安全与性能基本原则清单》各项适用要求所按照基于的方法,以及证明其符合性的文件。对于《医疗器械安全与性能基本原则清单》中不适用的各项要求,应当说明理由。
对于包括在产品注册申报资料中的文件,应当说明其在申报资料中的具体位置;对于未包括在产品注册申报资料中的文件,应当注明该证据文件名称及其在质量管理体系文件中的编号备查。
3.产品技术要求
申请人应按照产品的实际情况,拟定产品技术要求应符合《医疗器械注册与备案管理措施》等相关规定,应不低于产品适用的强制性国家标准/行业标准,按照《医疗器械产品技术要求编写指导原则》要求编写。
3.1产品型号/规格及其划分的说明
列表说明产品的型号、规格,弄清楚产品型号、规格的划分说明。提供各型号产品的结构图并标识根本尺寸。
3.2申报产品适用标准情况
申报产品应当符合适用的强制性标准。对于强制性行业标准,若申报产品结构特征、预期用途、使用方式等与强制性标准的适用范围纷歧致,申请人应当指出不适用强制性标准的说明,并提供经验证的证明性资料。
产品适用及引用的标准应适宜且齐全,在产品技术要求中所引用的相关国家、行业标准应完整并准确。对所引用的标准中的具体条款,应在产品技术要求中予以实质性采纳,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的可直接引述具体内容。
产品应符合现行有效的国家、行业标准,如涉及强制性国家、行业标准发布或修订,产品性能指标等要求应符合最新的强制性国家、行业标准。
以下表1中的标准为骨科外固定支架涉及的常用标准。申请人按照产品的特点可引用与之相适应行业外标准与其他特殊标准,且需说明理由。
表1相关产品标准
标准编号 | 标准名称 |
GB/T 230.1-2018 | 金属材料 洛氏硬度试验 第1部分:试验方法 |
GB/T 231.1-2018 | 金属材料 布氏硬度试验 第1部分:试验方法 |
GB/T 1031-2009 | 产品几何技术规范(GPS)表面结构 轮廓法 表面粗糙度参数及其数值 |
GB/T 1220-2007 | 不锈钢棒 |
GB/T 3280-2015 | 不锈钢冷轧钢板与钢带 |
GB/T 4226-2009 | 不锈钢冷加工钢棒 |
GB/T 1804-2000 | 一般公差 未注公差的线性与角度尺寸的公差 |
GB 4234.1-2017 | 外科植入物 金属材料 第1部分:锻造不锈钢 |
GB/T 4237-2015 | 不锈钢热轧钢板与钢带 |
GB/T 2965-2023 | 钛及钛合金棒材 |
GB/T 13810-2017 | 外科植入物用钛及钛合金加工材 |
GB/T 228.1-2021 | 金属材料 拉伸试验 第1部分:室温试验方法 |
GB/T 3621-2022 | 钛及钛合金板材 |
GB/T 3191-2019 | 铝及铝合金挤压棒材 |
GB/T 3190-2020 | 变形铝及铝合金化学成分 |
GB/T 3880.1-2023 | 一般工业用铝及铝合金板、带材 第1部分:一般要求 |
GB/T 4340.1-2024 | 金属材料 维氏硬度试验 第1部分:试验方法 |
GB/T 10128-2007 | 金属材料 室温扭转试验方法 |
GB/T 8013.1-2018 | 铝及铝合金阳极氧化膜与有机聚合物膜 第1部分:阳极氧化膜 |
GB/T 41873-2022 | 塑料 聚醚醚酮(PEEK)树脂 |
GB 18279.1-2015 | 医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认与常规控制的要求 |
GB/T18279.2-2015 | 医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南 |
GB 18280.1-2015 | 医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认与常规控制要求 |
GB 18280.2-2015 | 医疗保健产品灭菌 辐射 第2部分:形成灭菌剂量 |
GB/T 18280.3-2015 | 医疗保健产品灭菌 辐射 第3部分:剂量测量指南 |
YY/T 0149-2006 | 不锈钢医用器械 耐腐蚀性能试验方法 |
YY/T 0508-2009 | 外固定支架专用要求 |
YY/T 1782-2021 | 骨科外固定支架力学性能测试方法 |
ASTM F1541-24 | Standard Specification and Test Methods for External Skeletal Fixation Devices |
3.3性能指标
列举的基本技术指标为典型骨科外固定支架的指标,企业可参考相应的标准,按照企业自身产品的技术特点与用途制定相应的性能指标。技术要求应包括但不限于以下内容:
3.3.1外观
(1)外固定支架表面应光滑、洁净,不得有锋棱、毛刺、凹痕及裂纹等缺陷。
(2)外固定支架铝合金部件经阳极氧化处理后,有效面的色泽应均匀一致,无腐蚀、麻面、夹杂等可见缺陷。
(3)外固定支架的伸缩体应有刻度,刻度应完整清晰。
(4)提示性标记应完整、清晰。
3.3.2尺寸要求
外固定支架所有部件的主要尺寸与调节范围企业可自行规定。
3.3.3耐腐蚀性能
外固定支架的不锈钢部件应有良好的耐腐蚀性,应不低于YY/T 0149-2006中“沸水试验法”b级要求。铝合金制件的阳极氧化膜滴碱试验结果应符合GB/T 8013.1-2018的表7中的要求。铝合金制件的阳极氧化膜耐人工汗性(覆盖法)结果应符合GB/T 8013.1-2018的表7中的要求。
3.3.4表面粗糙度
外固定支架的金属部件表面粗糙度Ra值,应符合表2的规定。
表2 表面粗糙度(Ra) 单位:微米
外表特征 | 部 位 | |
外表面 | 其余 | |
有光亮 | ≤1.6 | ≤3.2 |
无光亮 | ≤3.2 | ≤6.3 |
3.3.5使用性能
外固定支架的转动部件在转动时应活动自如,无卡塞现象;调节装置应调节自如;锁紧装置应锁紧可靠,无松动现象;各部件螺纹配合性能应良好,不得有缺扣乱扣现象,保证互换性。
3.3.6力学性能
企业按照产品特点规定力学性能要求。
3.3.7无菌(若适用)
外固定支架以无菌状态交付时,产品应无菌。
3.3.8环氧乙烷残留量(若适用)
外固定支架若经环氧乙烷灭菌,其出厂时环氧乙烷残留量应≤ 10 μg/g。
3.4检验方法
产品的检验方法需按照技术性能指标设定,检验方法需优先按照基于国家标准/行业标准中的方法。对于相关国家标准/行业标准中不适用的条款,需说明不适用的原因。所有引用的标准注明其编号与年代号。自建检验方法需提供相应的方法学依据及理论基础,同时保证检验方法具有可操作性与可重现性,必要时可以按照基于相应图示开展说明,文本较大的可以附录形式提供。
4.同一注册单元内检验典型性产品确定原则
同一注册单元内所检验的产品应当能够代表本注册单元内其他产品的安全性与有效性,并提供典型性检验样品的确定依据。
典型产品的确定可以通过比较同一注册单元内所有产品的材质、结构组成、性能指标与预期使用部位等相应资料,说明其能够代表本注册单元内其他产品的安全性与有效性。对于力学性能要求注册申请人应按照各型号产品预期使用部位分别按照材质、结构组成与力学性能确定出最薄弱型号作为典型产品并提供确定依据及验证资料。对于技术要求中的非力学性能项目可选择有代表性的部件开展检测。
5.研究资料
5.1产品性能研究
在开展产品性能研究时,除对产品技术要求中所涉及的功能性、安全性及质量控制指标研究外,应至少对所申报产品的代表性样件开展力学性能的研究,力学性能研究应涵盖申报的所有规格型号产品,应按照临床使用条件,确定力学研究项目、参数及评价标准,并提供其确定依据、理论基础及相关验证资料,可参照YY/T 1782-2021、ASTM F1541-24提供产品力学性能相关研究资料。选择代表性样件时,可通过有限元研究或其他适用的研究方法。
5.2灭菌工艺研究
骨科外固定支架可以非无菌与无菌可归结成两种形式交付。注册申请人在对灭菌过程开展验证时,应全面考虑产品材质及灭菌方式的适宜性。
以非无菌形式提供时,注册申请人应弄清楚经过确认的灭菌方式,若该灭菌方式为行业内通用,注册申请人应提交灭菌过程对产品性能影响的相关验证资料;若该灭菌方式行业内不通用,注册申请人除提交灭菌过程对产品性能影响的相关验证资料外,还应当对灭菌效果开展确认,并提交相关资料。
以无菌形式交付时,注册申请人应选择与产品材质与性能相适宜的灭菌方式。若产品通过环氧乙烷开展灭菌,应按照GB 18279.1-2015、GB/T 18279.2-2015对灭菌过程开展确认,并提交灭菌确认报告。若产品通过辐照方式开展灭菌,应按照GB 18280.1-2015、GB 18280.2-2015、GB/T 18280.3-2015对辐射灭菌过程加以确认,并提交灭菌确认报告。
5.3产品有效期与包装研究
一般建议骨科外固定支架产品为一次性使用。
以无菌形式提供的产品应当对灭菌有效期开展验证确认并提交相关资料。灭菌有效期可采取实时验证或加速老化试验开展研究。
无论产品以何种状态交付,注册申请人均应弄清楚产品包装材料并提交相关研究资料。
5.4联合使用
产品配合骨针实现预期用途,应当提供证明联合使用安全有效的研究资料,包括配合结构研究、联合使用风险及控制措施、兼容性研究等。例如支架与骨针的连接方式(如针夹结构、找准机制)的力学研究,通过有限元模拟验证应力分布(避免骨针孔处应力集中结果断裂);材料兼容性研究,如支架与骨针的电化学兼容性等。
5.5证明产品安全性、有效性的其他研究资料。
(四)临床评价资料
该产品列入《免于开展临床评价医疗器械目录》,若原材料按照基于不锈钢、铝合金、碳纤维或钛合金,注册申请人可免于提交临床评价资料。
若申报产品原材料(如聚醚醚酮、增强型聚醚醚酮或其他新型材料)、预期使用目的不在《免于开展临床评价医疗器械目录》的产品描述范围内,或不能证明与已获准境内注册产品具有基本等同性,应当按照《医疗器械临床评价技术指导原则》等文件开展临床评价。
(五)产品说明书与标签样稿
产品说明书、标签与包装标识需符合《医疗器械说明书与标签管理规定》以及YY/T 0466.1、YY/T 0508等相关标准要求。此外,需结合产品特点弄清楚以下内容:
1.弄清楚产品以无菌或非无菌状态交付。若为无菌产品,需标注清楚有效期;非无菌产品,则应给出推荐的灭菌方式与参数;
2.详细给出产品的使用方法,包括临床医生应具备的知识与技能,必要时可附操作流程简图;
3.弄清楚运输方法及条件,如温度、湿度、防震要求等。说明储存环境要求,如温度、湿度、通风条件等;
4.弄清楚适用范围,全面、如实告知产品可能存在的风险,如连接件松动、材料断裂变形等,并提供相应的防范措施与警示信息;
5.说明书内容应与注册申报的其他资料,如综述资料、产品技术要求、研究资料等注册申报资料的内容保持一致,不得相互矛盾;
6.应参照YY/T0466.1等相关标准中的规定,对标签中使用的图形、符号、缩写等内容开展解释说明;
7.每件外固定支架还应符合YY/T 0508的规定,应有下列标志:
(1)制造商代号或商标;
(2)出厂年代或生产日期;
(3)材料标志。
8.如有与申报产品预期配合使用的医疗器械(如金属骨针),需在说明书中弄清楚配合使用产品信息。
(六)质量管理体系文件
需按照《关于公布医疗器械注册申报资料要求与批准证明文件格式的公告》提交相关文件。
三、参考文献
[1]中华人民共与国国务院.医疗器械监督管理条例:中华人民共与国国务院令第739号[Z].
[2]国家市场监督管理总局.医疗器械注册与备案管理措施:国家市场监督管理总局令第47号[Z].
[3]国家药品监督管理局.医疗器械注册申报资料要求与批准证明文件格式:关于公布医疗器械注册申报资料要求与批准证明文件格式的公告2021年第121号[Z].
[4]国家食品药品监督管理总局.医疗器械说明书与标签管理规定:国家食品药品监督管理总局令第6号[Z].
[5]国家食品药品监督管理总局.医疗器械分类规则:国家食品药品监督管理总局令第15号[Z].
[6]国家食品药品监督管理总局.医疗器械通用名称命名规则:国家食品药品监督管理总局令第19号[Z].
[7]国家药品监督管理局.关于发布医疗器械产品技术要求编写指导原则的通告:2022年第8号[Z].
[8]国家食品药品监督管理局.医疗器械分类目录:2017年第104号[Z].
[9]国家药品监督管理局.医疗器械通用名称命名指导原则:2019年第99号[Z].
[10]国家药品监督管理局.国家药监局关于发布免于开展临床评价医疗器械目录的通告:2025年第19号[Z].
[11]GB/T 230.1-2018,金属材料 洛氏硬度试验 第1部分:试验方法[S].
[12]GB/T 231.1-2018,金属材料 布氏硬度试验 第1部分:试验方法[S].
[13]GB/T 1031-2009,产品几何技术规范(GPS)表面结构 轮廓法 表面粗糙度参数及其数值[S].
[14]GB/T 1220-2007,不锈钢棒[S].
[15]GB/T 3280-2015,不锈钢冷轧钢板与钢带[S].
[16]GB/T 4226-2009,不锈钢冷加工钢棒[S].
[17]GB/T 1804-2000,一般公差 未注公差的线性与角度尺寸的公差[S].
[18]GB 4234.1-2017 ,外科植入物 金属材料 第1部分:锻造不锈钢[S].
[19]GB/T 4237-2015,不锈钢热轧钢板与钢带[S].
[20]GB/T 2965-2023,钛及钛合金棒材[S].
[21]GB/T 13810-2017,外科植入物用钛及钛合金加工材[S].
[22]GB/T 228.1-2021,金属材料 拉伸试验 第1部分:室温试验方法[S].
[23]GB/T 3621-2022,钛及钛合金板材[S].
[24]GB/T 3191-2019,铝及铝合金挤压棒材[S].
[25]GB/T 3190-2020,变形铝及铝合金化学成分[S].
[26]GB/T 3880.1-2023,一般工业用铝及铝合金板、带材 第1部分:一般要求[S].
[27]GB/T 4340.1-2024,金属材料 维氏硬度试验 第1部分:试验方法[S].
[28]GB/T 10128-2007,金属材料 室温扭转试验方法[S].
[29]GB/T 8013.1-2018,铝及铝合金阳极氧化膜与有机聚合物膜 第1部分:阳极氧化膜[S].
[30]GB/T 41873-2022,塑料 聚醚醚酮(PEEK)树脂[S].
[31]GB 18279.1-2015,医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认与常规控制的要求[S].
[32]GB/T18279.2-2015,医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南[S].
[33]GB 18280.1-2015,医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认与常规控制要求[S].
[34]GB 18280.2-2015,医疗保健产品灭菌 辐射 第2部分:形成灭菌剂量[S].
[35]GB/T 18280.3-2015 ,医疗保健产品灭菌 辐射 第3部分:剂量测量指南[S].
[36]YY/T 0149-2006,不锈钢医用器械 耐腐蚀性能试验方法[S].
[37]YY/T 0508-2009,外固定支架专用要求[S].
[38]YY/T 1782-2021,骨科外固定支架力学性能测试方法[S].
[39]ASTM F1541-24,Standard Specification and Test Methods for External Skeletal Fixation Devices[S].
[40]YY/T 0681.1-2018 无菌医疗器械包装试验方法 第1部分:加速老化试验指南[S].
[41]GB/T 42062-2022 医疗器械 风险管理对医疗器械的应用[S].
[42]YY/T 0466.1-2016 医疗器械 用于医疗器械标签、标记与提供信息的符号 第1部分:通用要求[S].
附表
产品主要危险(举例)
危险的分类 | 危险的形成因素 | 可能的后果 |
性能密切相关的危险 | 按照基于不适宜的灭菌方式,结果产品力学性能下降 | 使用时不能很好地在患者骨折部位开展固定,影响患者骨折部位的愈合 |
生物与化学危险 | 经环氧乙烷灭菌的产品出厂时环氧乙烷解析不彻底,残留量超标 | 临床大夫及患者接触过量的环氧乙烷,损害临床大夫及患者健康 |
生产过程中原材料、包装材料等微生物的污染,结果产品菌落超标,产品灭菌不彻底 | 细菌接触患者,患者被细菌感染,严重时结果发热、休克 | |
产品未灭菌;或未按已确认的工艺实施灭菌,产品灭菌不彻底,产品带菌 | 细菌接触患者,患者被细菌感染,严重时结果发热、休克 | |
可用性 | 由不熟练/未经培训的人员使用 | 可能造成骨折对位不良愈合或再移位,给患者造成身体伤害 |
非无菌形式交付,包装形式与无菌状态相似,大夫误以为无菌产品即带入手术室 | 污染手术室环境,造成患者感染 | |
对适应人群与禁忌症的说明不充分 | 临床大夫将产品用于不适宜的症状或人群,可能会造成手术失败,给患者带来身体伤害 |
注:上表内容仅为风险研究示例,并不用于注册申请人风险管理报告的制定,注册申请人应按照自身实际风险研究情况,确定其危害,制定产品风险管理报告。针对产品的各项风险,企业应采取应对措施,确保风险降到可接受的程度。



 1287
1287

