本指导原则旨在指导注册申请人规范血管内超声诊断(intravascular ultrasound英文缩写IVUS)设备与导管注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对血管内超声诊断设备与导管的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。
本指导原则是供申请人与审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如有能够满足法规要求的其他方法,也可以按照基于,但应提供详细的研究资料与验证资料。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断改进与科学技术的不断发展,本指导原则相关内容也将适时开展调整。
一、适用范围
本指导原则适用于血管内超声诊断设备。血管内超声诊断设备通常由主机、患者接口单元(Patient Interface Unit英文缩写PIU)、一次性使用血管内超声诊断导管与相关附件组成。产品工作原理、结构组成与临床应用的介绍详见附件1。与血管内光学相干断层扫描(Optical Coherence Tomography英文缩写OCT)或冠状动脉血流储备分数(Fractional Flow Reserve英文缩写FFR)功能组合的设备,其IVUS部分应满足本指导原则。
二、注册审查要点
(一)监管信息
1.注册单元划分
建议将设备与导管作为一个注册单元,也可分开注册。因为设备与导管的匹配性对产品的安全有效性有较大影响,各部分的设计开发需要作为一个系统统筹规划,整体开展安全有效性评价。若设备与导管的注册人不同,应提交技术合作协议以确保系统整体的安全有效性。
导管单独注册的,仅用于冠脉血管与仅用于外周血管的须划分不同注册单元,不同设计原理(如相控阵、机械旋转)的须划分不同注册单元。
设备单独注册的,根本部件(电源组件、超声驱动组件等)与超声驱动软件一致,结构外形相似,主要性能指标相近,存在一个型号可与所有可配用超声导管配合使用且具有注册单元内其他型号的全部软件功能,仅在软件功能与外观布局上存在一定差异的一组型号可作为一个注册单元。例如,一体式与分体式设备须划分不同注册单元,配用导管完全不同的主机须划分不同注册单元。
2.产品名称
产品名称应符合《医疗器械器械通用名称命名指导原则》。设备与导管一并注册或设备单独注册的,产品名称应按照基于“血管内超声诊断设备”;导管单独注册的,产品名称应按照基于:一次性使用冠脉血管内超声诊断导管(对于仅可用于冠脉血管的)、一次性使用外周血管超声诊断导管(对于仅可用于外周血管的)、一次性使用血管内超声诊断导管(对于可同时用于冠脉与外周血管的)。
对于OCT与IVUS二合一的产品:设备与导管一并注册或设备单独注册的,产品名称应按照基于“血管内成像设备”;导管单独注册的,产品名称应按照基于:一次性使用冠脉血管内成像导管(对于仅可用于冠脉血管的)、一次性使用外周血管内成像导管(对于仅可用于外周血管的)、一次性使用血管内成像导管(对于可同时用于冠脉与外周血管的)。
对于与FFR组合的产品:设备与导管一并注册或设备单独注册的,产品名称应按照基于“血管内诊断设备”;尚未出现二者组合的导管。
以上产品名称根本词为“设备”的,若符合GB 9706.1标准中电气系统的定义,根本词也可使用“系统”。
3.管理类别与分类编码
按照2017版《医疗器械分类目录》,本产品管理类别为第三类,设备与导管一并注册或设备单独注册的,分类编码为06-07-01,导管单独注册的,分类编码为06-08-04。
4.型号规格与结构组成
型号规格栏建议仅体现主要部分,即:设备与导管一并注册或设备单独注册的,仅体现设备或系统的型号;导管单独注册的,仅体现导管的型号。相对独立的组件应在结构组成中同时体现型号,如通常随设备注册的患者接口单元/马达、脚踏开关等。无电气、功能连接的推车不建议作为产品组成部分。
导管的结构组成建议描述为导管体(含换能器)、操作手柄(如适用)、连接器(如适用)。
5.适用范围
设备与导管一并注册的,适用范围规范为:在医疗机构中使用,用于需要开展血管介入治疗患者的冠状动脉/外周血管超声成像检查。
外周血管应进一步弄清楚具体血管名称,如颈动脉、胸主动脉、腹主动脉、下腔静脉、肾动脉、髂动脉、髂静脉(若髂动脉、髂静脉均可使用,可合并描述为髂动静脉,下同)、股动脉、股静脉、腘动脉、腘静脉、膝下动脉、膝下静脉(膝下血管可不再具体区分)等。
设备的适用范围规范为:在医疗机构中使用,与XX公司的一次性使用冠脉/外周血管内超声诊断导管/成像导管(型号:XXX)配合使用,用于需要开展血管介入治疗患者的冠状动脉/外周血管超声成像检查。外周血管无需进一步弄清楚具体血管名称。若有OCT、基于冠脉IVUS影像计算获得血流储备分数的功能,应一并体现。
导管的适用范围规范为:在医疗机构中使用,与XX公司的血管内超声诊断设备(型号XXX,软件发布版本号XXX)配合使用,用于冠状动脉/外周血管内超声成像检查。外周血管应进一步弄清楚具体血管名称。
(二)综述资料
应按照《关于公布医疗器械注册申报资料要求与批准证明文件格式的公告》附件5《医疗器械注册申报资料要求及说明》的要求提供综述资料,弄清楚产品设计开发立题依据,如产品设计特点、临床应用部位等,重点描述以下内容:
应当弄清楚产品的结构及组成,弄清楚各组成部件的型号规格,并给出产品外观及结构示意图、换能器的外观及内部结构示意图。设备应包括硬件结构、软件功能及电子接口等内容。导管应给出型号、尺寸、各部件名称与与人体接触的材料、是否为一次性使用、是否为无菌包装、灭菌方式、一次性使用部件的货架有效期、可重复使用次数(若适用)。弄清楚导丝共轨段长度、位置。弄清楚换能器的材料类型(如压电陶瓷、单晶体)、尺寸、布置位置。若带有涂层,应给出涂层成分、涂层特征及作用、涂层在器械上的位置及涂覆范围、涂层涂覆方式及工艺。
详述产品各项临床应用软件功能的原理、根本算法、使用方法、临床性能要求(如测量准确性、重建准确性、配准准确性、分类/识别准确性等),提供主要用户界面。
注册单元包括多个型号的,详述型号间差异。
详述配合使用产品的情况。
(三)非临床资料
1.产品风险管理资料
申请人可参考GB/T 42062及YY/T 1437标准对产品开展全生命周期风险管理,提交风险管理资料。结合产品自身设计特点、临床用途及使用场景,充分识别与安全密切相关的特征,开展风险研究、评价及控制。风险控制的方案与实施、综合剩余风险的评价可参考GB/T 42062标准第7、第8章的相关要求。应确保各风险的可追溯性,提供各风险及综合剩余风险的可接受准则,确认各风险及综合剩余风险可接受。
2.医疗器械安全与性能基本原则清单
按照产品特征提交医疗器械安全与性能基本原则清单。
3.产品技术要求与检测
3.1规格信息
给出型号规格命名规则。以下内容也可在附录中体现。
涉及软件,应给出软件发布版本号及软件版本号命名规则。涉及较复杂或新颖的软件功能的,应概述其功能原理与临床应用,给出主要用户界面。
无菌提供的,应给出灭菌方式、货架有效期。
给出包括所有产品组成的图示,体现主要特征与尺寸。配合图示给出所有与人体接触部分的材质。导管应给出结构图及各段主要尺寸,弄清楚导丝交换类型(全导管式OTW、快速交换式)与导丝腔处于导管的位置、共轨段长度,导管头端特殊造型,弄清楚换能器位置、尺寸、类型(如压电陶瓷、单晶体等)、数量、布局。若有涂层,弄清楚涂层主要成分、涂层类型(水合、非水合)及涂覆范围等。
3.2性能指标
设备与导管的超声成像性能指标参照YY/T 1659与超声诊断设备相关标准制定,包括:声工作频率、成像半径、轴向分辨力、侧向分辨力、回撤方向分辨力、纵向几何位置精度、横向几何位置精度、回撤方向的几何位置精度、图像几何畸变等。同时支持OCT的双模态导管应有二者配准准确性的性能指标。给出所有可设置的回撤速度及其对应帧率与最大回撤距离的性能指标,建议列表,不同回撤速度下上述超声成像性能若有差别可分别给出,否则所有回撤速度下均需满足上述性能指标。不同型号或与不同产品配用时性能有差异的应分别给出。产品同时具有血管内OCT、FFR、基于冠脉IVUS影像的血流储备分数计算功能的,应给出相关性能指标,具体要求参考相关指导原则或标准。
设备还应制定如下性能指标:外观与结构、设备与导管的连接牢固度、脚踏开关(如适用)、软件功能、使用限制、接口、访问控制、运行环境(若适用)、性能效率(若适用)。软件功能如导管识别(如RFID)、
回撤方向血管/支架三维重建、血管评估、斑块负荷计算、斑块性质研究、造影配准、基于冠脉IVUS影像的血流储备分数计算等。其中血管评估应细化描述可评估的内容,如管腔面积计算、外弹力膜识别、狭窄比、血管分叉识别等。上述软件功能目前主要用于冠脉血管,若可用于外周血管,应予以弄清楚。
导管还应参照YY 0285.1等标准制定如下性能指标:配用导丝尺寸、射线可探测性、外表面、耐腐蚀性(如适用)、峰值拉力、无泄漏、座(鲁尔接头)、侧孔(如适用)、末端头端、外径、有效长度、导管识别(如RFID)、化学性能(如酸碱度、重金属总含量、紫外吸光度、蒸发残渣、还原物质)、无菌、环氧乙烷残留量(如适用)、细菌内毒素、微粒污染。
若包括注射器,参考《一次性使用输注器具产品注册审查指导原则(2023年修订版)》至少包括但不限于以下性能指标:产品外观、刻度容量允差、刻度标尺、外套、活塞组件、锥头、性能(残留容量、器身密合性、滑动性能、外套与活塞组件的配合)等物理性能,酸碱度、可萃取金属含量、易氧化物、环氧乙烷残留量(如适用)等化学性能,无菌、细菌内毒素等其他性能。对于仅具有机械旋转式超声导管的产品,因为注射器仅用于导管内注射液体排气,除非导管破损,注射液不会与人体接触,无需给出与人体接触时考虑的性能指标。
若包括无菌袋,应制定以下性能指标:无菌、环氧乙烷残留量(如适用)。
3.3检测单元划分
检测组合原则:导管与设备一般分别注册,但超声性能、电气安全与电磁兼容的检测,需要在弄清楚相互配合使用关系的前提下统筹考虑检测单元。如:设备注册单元包括A、B型主机,可配合a、b、c型导管(不在本注册单元内),则需要统筹考虑Aa、Ab、Ac、Ba、Bb、Bc六种组合在各项检测中的典型性,导管注册单元亦然。申请人应依据本节的各项原则开展检测典型性研究,并提供检测典型性说明。
超声性能:设备(含患者接口单元)与导管的不同组合若超声成像方面的软硬件设计、导管结构设计一致,仅在设备结构外观、操作界面等存在差异,可以互相代表。导管除标签、色标外,其他的实质设计差异在超声性能方面一般不具有检测代表性,尤其是机械旋转式超声导管,即使管身的材料、尺寸、结构设计变更,也可能对弹簧管传动产生影响,进而影响超声成像性能。例如:超声根本部件与驱动软件一致的主机可选择一个典型型号检测,不同设计、材料、长度、超声工作频率的导管均应分别检测,。
后处理软件,可结合软件特点选择典型配用导管检测。
导管物理性能:对于不同直径、不同长度的导管应分别检测,其他结构差异对相关项目有影响的应开展差异检。
导管化学性能、无菌、环氧乙烷残留量、内毒素、微粒污染:若结构、材料、灭菌工艺基本一致,可选尺寸最大的作为典型性检测。
电气安全:设备与导管的不同组合,电源组件完全一致,软件平台一致,硬件平台相似(含导管),外形结构相似,仅在外观布局上存在一定差异的系列产品,可选择一个典型组合开展检测。通常一台典型主机配合一根典型导管检测即可,其他型号的差异若对相关条款有影响的可开展差异检。
电磁兼容:设备与导管的不同组合,若电磁兼容相关的结构有任何差异,原则上均应分别检测。通常不同主机配用不同导管均应分别检测。电磁兼容试验按照预期最不利/最大发射的试验条件设置样机的运行模式。电磁检测报告的基本性能至少应包括GB 9706.237的6条基本性能:
(1)不得产生可能归咎于生理反应、期望可能改变诊断结果的波形噪声、图像伪影或失真、或显示数字值错误;
(2)不得产生与所开展的诊断相关的不正确数字值的显示;
(3)不得产生与安全相关指示的不正确显示;
(4)不得产生非预期或过量的超声输出;
(5)不得产生非预期或过量的换能器组件表面温升;
(6)不得使预期体内使用的换能器组件产生非预期的或非受控的运动。
4.研究资料
4.1物理与化学性能研究
4.1.1物理与化学性能
需提供产品性能指标的确定依据、设计输入来源以及临床意义,所按照基于的标准或方法、按照基于的原因及理论基础。
自动回撤功能,研究回撤速度、帧率、切片厚度(单帧行进距离)、成像性能的关系,研究不同回撤速度下成像质量的差异,是否均满足临床需求。
同时支持OCT的双模态导管,应提交IVUS与OCT同时、同位、同轴、同向成像的研究资料,即验证IVUS与OCT图像同步关系,可通过台架实验或动物试验验证;在开展一致性验证时需关注回撤速度的典型性是否充分。
应结合产品实际使用情况,研究产品的不同状态(如:运动及弯曲下)对各项成像性能的影响,考虑在最不利状态下开展成像性能的相关验证,研究易出现机械旋转不均匀现象(Non-Uniform Rotational Distortion英文缩写NURD)的情形、处理措施及设计改进,并与标准测试状态下结果开展比较,提供相关研究资料。
声能安全研究:应提交血管内超声设备配合导管使用时的声输出测试报告,主要关注机械指数(MI)、热指数(TI)、空间峰值时间平均声强(ISPTA.3)及空间峰值脉冲平均声强(ISPPA)的限值,需均满足相关国际公认限值要求。
应提供导管与人体接触部分的化学材料表征。带有涂层的,应按照《带有润滑涂层的血管介入器械注册审查指导原则》提交资料,对声称的预期使用期限内使用与再处理(如适用)的涂层完整性、润滑性能等开展研究。关于涂层完整性,建议在具有代表性的典型模型中开展模拟试验(使用、再处理)并收集测试前后数据,按照基于光学显微等方法通过了解涂层表面的变化。宜评价模拟使用中可能脱落的微粒,即在模拟使用后对收集的微粒开展量化,验证结果应基于预期用途讨论涂层脱落以及所产生微粒是否可接受并给出合适理由。对于首次应用于医疗器械的涂层材料,宜结合接触方式、接触时间等提供材料安全性评价。
4.1.2联合使用
设备与导管分开注册的,需整体验证安全有效性。
弄清楚可配用导管鞘、导丝的规格,并提供与导管鞘、导丝联合使用的研究资料,建议在血管模型中开展,并对导管的操控性能开展评价。
机械旋转式IVUS,需验证配用注射器的操作阻力、超声耦合通道形成速度与稳定性等临床使用性能。若注册单元含注射器且说明书要求仅配用此注射器,仅验证专用注射器即可,否则应弄清楚注射器要求并选择典型注射器开展验证。
联合药物使用的导管应提交药物相容性研究资料。
4.2电气系统安全性研究
应提供电气安全性及电磁兼容性的研究资料。目前与本产品相关的标准包括:
GB 9706.1《医用电气设备 第1部分:基本安全与基本性能的通用要求》。
GB 9706.237《医用电气设备 第2-37部分:超声诊断与监护设备的基本安全与基本性能专用要求》
YY 9706.102《医用电气设备 第1-2部分:基本安全与基本性能的通用要求 并列标准:电磁兼容 要求与试验》
4.3软件与网络安全研究
设备需按照《医疗器械软件注册审查指导原则》的要求提供软件研究资料,按照《医疗器械网络安全注册审查指导原则》提交网络安全研究资料。导管单独注册时,应提供配用设备的软件研究资料。若设备及相应软件版本已获批与申报导管配合使用,则无需重复提交软件研究资料,仅需提供设备的受理号、注册证号等以证明配合关系。
对于血管评估、斑块负荷计算等功能的测量部分,应提交准确性验证资料。血管评估、斑块识别/研究、基于冠脉IVUS影像计算血流储备分数等功能,若涉及人工智能算法,应按照《人工智能医疗器械注册审查指导原则》提交算法研究资料。
4.4生物学特性研究
生物相容性应考虑所有可能与患者直接或间接接触的部件,实验样品应为成品。导管预期与人体血路接触,参照GB/T 16886.1开展生物学评价或试验,包括:细胞毒性、致敏反应、刺激或皮内反应、热原、急性全身毒性与血液相容性,其中,血液相容性一般包括溶血、凝血、血栓形成等,具体可参照GB/T 16886.4。注射器(若有)若在正常使用时与人体血液间接接触,要求同导管,若仅用于机械旋转式IVUS导管注液排气不与人体接触则无需开展试验。
4.5清洗、消毒、灭菌研究
按照产品组成各部分的使用方式确定消毒或灭菌级别。导管、注射器(如有)、无菌袋(如有)通常为一次性使用,生产企业灭菌,应弄清楚灭菌方法与完整的灭菌参数(包括根本循环参数与残留水平研究),并提供灭菌确认报告。对于按照基于辐照灭菌的器械,应当提供辐照剂量,对于环氧乙烷(EO)灭菌器械,应当提供EO、2-氯乙醇的最大残留水平及其研究资料。若按照基于典型型号,应从灭菌难度的角度给出典型性选择依据,考虑的因素一般包括导管长度、直径、结构与材料等。
要是直接或间接患者接触材料可重复使用,则应当提供重复使用说明(包括在限定的重复使用次数内满足产品使用性能的清洗、消毒及灭菌方法),规定允许重复使用的最多次数,并提供可以证明该组件可安全消毒与/或灭菌的证据,给出所指出的消毒/灭菌的方法确定的依据。对可耐受两次或多次灭菌的产品,应当提供产品相关推荐的灭菌方法耐受性的研究资料。
对于常规清洁消毒的组件,应提供其工艺参数及确定依据。
4.6动物试验
可依据《医疗器械动物试验研究注册审查指导原则 第一部分:决策原则》决策是否需开展动物试验研究。开展动物试验研究时宜符合《医疗器械动物试验研究注册审查指导原则 第二部分:试验设计、实施质量保证》中的相关建议。
弄清楚动物模型与动物试验的具体信息,小型猪是目前常用的试验动物,亦可使用其他适合的动物模型,如具有足够粗细的血管以满足常规支架植入手术、适应按人类应用设计的支架植入的动物。动物数量可靠,能达到预期试验目的所需的最少数量。
动物试验主要评价申报产品的成像质量、操控性、安全性等方面,宜设置对照组,实验器械与对照器械一般应在不同动物上使用。若无法稳定构建动物血管病变模型,动物试验可仅针对健康血管开展评价,由其他试验考察血管病变诊断性能。对于同时支持OCT的双模态导管,仅验证二者图像同步关系的无需对照。
评价指标主要包括超声成像质量、回撤平稳性及其成像质量、操控性(导管鞘、导丝兼容性、推送性、通过性、显影性等)、支架成像与长度面积测量准确性、不良事件(内皮损伤、夹层、血栓、穿孔等)出现率、大体解剖与组织病理学。还应评价:NURD现象产生与处理、试验动物状态、系统稳定性、操作满意度、血管细节结构成像质量(如血管分层、外弹力膜、血管分支、伴行静脉等)等。部分安全性指标通常需要至少几周才能通过了解到结果变化,如内皮损伤的愈合、血栓形成。涉及软件功能的,制定相应指标开展评价,如图像重建质量、血管评估子功能有效性、造影配准准确性、基于冠脉IVUS影像计算获得血流储备分数准确性等。
冠脉IVUS评价须包括冠脉3条主要分支右冠状动脉(RCA)、左前降支(LAD)、左回旋支(LCX)。外周血管IVUS评价:导管须包括适用范围预期申报的所有血管,到达导管可到达的极限位置与血管直径并予以记录;设备须至少包括临床常用的最粗与最细血管,建议以颈动脉或主动脉、膝上动静脉为代表。
图像质量相关评估应按照血管位置/分支、有无支架/斑块/血栓等情况结合相关诊疗指南与共识形成5分制Likert评分量表。由有具有丰富IVUS使用与诊断经验的相关科室临床医生阅片。至少按照基于双人独立评价的方式评片,当评价结果纷歧致时,以较低评价为准;也可按照基于高水平第三人仲裁,若选用仲裁判定方式,需弄清楚规定仲裁判定标准。设置对照的,应尽可能保证盲态评估,并对两组各项评价结果开展比较评估。
设备与导管组合的代表性:(1)对于图像质量相关评估,动物试验样品的典型性确定原则与超声性能检测的典型性一致;(2)对于操控性、安全性相关指标,在图像质量相关评估典型性原则基础上,若驱动软件、导管机械设计、材料等差异会带来显著影响,至少开展血管模型试验,必要时开展针对性的动物试验评估;(3)对于后处理软件,需按照具体情况研究,原则上若与超声成像或血管部位关系较弱的,选择一根典型导管即可。
4.7可用性研究
本产品现阶段可按照《医疗器械可用性工程注册审查指导原则》提交使用错误研究报告,研究范围应包括全部结构组成、全部软件功能。也可提交可用性工程研究报告。
4.8稳定性研究
对于设备,应模拟实际工作状态开展最不利情形下的疲劳试验,并在试验后对产品的性能、安全开展验证。患者接口单元的预期使用期限可与主机不同,应一并验证。导管一般为一次性使用,应提供货架有效期研究资料,若含有涂层,建议对加速老化或者实时老化后产品性能验证项目增加涂层相关性能的评价,宜结合影响涂层材料稳定性的因素,考量涂层是否对包装有特殊要求以及初包装形式是否对涂层产生不利影响。
应对产品的所有组成部分开展运输稳定性研究,包括但不限于湿度储存、堆叠、碰撞、坠落、运输等试验,验证包装完整性与产品性能。模拟运输试验与环境试验可参考GB/T 14710与YY/T 1420要求开展。
(四)临床评价资料
对于常规冠脉与外周血管IVUS设备与导管及相关软件功能,可按照基于同品种比对路径开展临床评价。若产品按照基于了全新的设计,或参数与已有产品有显著差异(通常是因为提升某一性能,但可能以减少其他性能为代价),通过非临床验证无法证明差异不对安全有效性产生不利影响,应考虑开展临床试验。斑块性质判定、基于冠脉IVUS影像计算血流储备分数,应通过临床试验路径开展临床评价。
1.同品种产品的选择
申请人通过同品种比对方式开展血管内超声诊断系统的临床评价时,可选用一个或多个同品种产品开展比对, 宜优先选择与申报产品适用范围一致、技术特征一致或尽可能相似的产品作为同品种产品。若所选同品种不是具有长期临床安全应用史的产品,建议将其选做可比器械开展比对与评价。
2.适用范围及临床使用相关信息的比较
比较申报产品与同品种产品在适用范围以及临床使用相关信息的一致性与差异性,建议重点考虑:
(1)适用范围:适用的血管类型(冠脉/外周,外周的具体血管)。
(2)使用方法:产品的使用操作步骤。
(3)配用产品:产品配用的一次性使用血管内超声导管/主机等信息。
3.技术特征的比较
申报产品与同品种产品技术特征的具体比较项目,建议重点考虑以下内容(包括但不限于):
3.1工作原理,如导管的机械旋转型与相控阵型,回撤实现方式,机械旋转转速成像参数等。
3.2结构组成,主机包括不同的结构模块,机械旋转导管主要由成像芯丝与导管体组成,相控阵导管主要由圆柱形超声换能器与导管管体组成。
3.3产品性能、功能及其他根本技术特征
血管内超声产品主要关注于医学成像质量相关参数、物理机械性能(导管)、通过性能(导管)、软件功能(主机)等,申请人可参考国行标规定的模型与测试方法提供相关性能的比较测试,亦可自主选择科学的体模、测试方法获得性能的比较,以论证申报产品与同品种产品的等同性。
(1)医学成像质量相关参数:声工作频率、成像半径、轴向分辨力、侧向分辨力、回撤方向分辨力(如适用)、纵向几何位置精度、横向几何位置精度、回撤方向几何位置精度(如适用)、图像几何畸变等。若无声工作频率一致的产品,应尽量选择接近的,或虽然声工作频率不同但主要成像参数接近的产品。
(2)物理机械性能:导管尺寸(应包括外径、有效长度)、头端构型(包括头端形状、长度)、射线可探测、抗拉强度、弯曲疲劳耐受性、导管部件断裂力等。
(3)导管通过性能:有无亲水涂层(材料)、推送力、推送速度、回撤范围、回拉位移、回拉速度、回拉旋转角度等。
(4)软件根本功能:图像模式(如血管截面图、三维重建图等)、血管评估参数测量(血管图像重建完毕后,能够直接在重建图上测量血管段的管腔面积,病变长度、狭窄比等)、斑块负荷计算、斑块性质研究、造影配准,比较工作原理、算法及上述功能的主要性能指标。
4.差异性部分的安全有效性证据
申请人可将申报产品与一个或多个同品种产品开展比较,详述二者的一致性与差异性。针对差异性,提交差异不对申报产品的安全有效性产生不利影响的支持资料,从而论证申报产品的安全有效性。
一般来说,不同产品的硬件、软件、性能等可能存在差异,可按照需验证的差异内容,设计可靠的验证试验,论证差异部分的安全有效性。验证试验一般包括验证测试/模型试验、动物试验、人体图像样本。
4.1台架测试
产品的硬件(包括导管的材质、设计)、软件、性能与同品种有差异,一般需提供相应的台架测试:基于血管模型的通过性与到达性测试,基于成像体模的图像获取、成像质量以及测量准确性的评价。相关测试模型原则上需考虑模拟血入路的通路长度、血管弯曲度、分叉情况、特殊操作(如主髂分叉的“翻山”操作)等,以及靶血管(如冠脉)的形态与尺寸等,应包括最不利的情形,试验时应血管模型中应模拟血液环境,例如可以考虑基于人体真实CT图像开展3D打印获得的模型。
血管内成像导管临床使用中对可操作性要求较高,导管能否按预期达到指定位置对血管开展成像对血管状态的评估十分重要,因此针对可能结果影像操作性的差异,如管身材料,尖端长短等应提供模拟使用台架试验。
对于换能器及成像相关软硬件设计的差异,应提供导管图像评估(动物试验与人体图像样本)。
4.2动物试验
动物试验可进一步验证产品的精准性、可靠性及在活体使用的安全有效性。详见非临床动物试验要求。若与同品种差异仅限于成像质量、操控性、安全性的某些方面,则无需评价不相关的方面。
4.3人体图像样本
因为动物试验无法模拟病变,若不通过临床试验路径申报,应对常见典型血管病变开展人体图像样本确认研究。此项研究主要针对成像功能(含回撤)、病变相关的血管评估功能。
典型病变如不同类型的动脉粥样硬化性、钙化病变、分叉病变、慢性完全闭塞(CTO)病变、支架内再狭窄/支架内血栓,每个设备与导管的典型组合应针对每种典型病变提供至少1例图像样本(包括回撤与典型切面),软件功能或声称特殊优势应结合所适用病变一并评估。冠脉IVUS须包括冠脉3条主要分支右冠状动脉(RCA)、左前降支(LAD)、左回旋支(LCX)。外周血管IVUS须包括适用范围预期申报的典型血管,血管典型性主要以穿刺入路、导管推送距离与屈曲程度、血管直径、血管内部结构(因为下肢静脉因为静脉瓣的存在不应与相应动脉互为典型)特点为判定依据。在保证病变类型的前提下,应尽可能多的覆盖血管部位、小直径等。
图像质量相关评估应按照血管位置/分支、有无支架、斑块/血栓情况等结合相关诊疗指南与共识形成5分制Likert评分量表。因为人体图像样本评价重点关注病变,量表评价项目应与动物试验量表侧重有所差异。应由有具有丰富IVUS使用与诊断经验的相关科室临床医生阅片。至少按照基于双人独立评价的方式评片,当评价结果纷歧致时,以较低评价为准;也可按照基于高水平第三人仲裁,若选用仲裁判定方式,需弄清楚规定仲裁判定标准。
获取人体图像的过程需符合研究所在地法规的要求,并获得伦理委员会批准,麻醉与介入操作须严格执行相关要求与操作规程。
4.4结果研究
若申报产品的测试与研究结果不差于同品种产品,则可收集同品种产品的临床数据集,以证明申报产品自身的安全有效性。若申报产品的部分测试或研究结果差于同品种产品,需结合申报产品的拟使用的临床情况、已上市同类产品的水平、申报产品的临床数据(如有)、临床诊疗要求等资料,综合研究申报产品的临床可接受性,若已有数据无法证明申报产品安全有效,必要时提交自身临床数据。
5.同品种产品的临床数据
应参考《医疗器械临床评价技术指导原则》要求,提交同品种产品的临床数据;临床试验或临床使用获得的数据(以下简称临床数据)可来自中国境内与/或境外公开发表的科学文献与合法获得的相应数据,包括临床试验数据、临床经验数据、临床文献数据等。
具有长期临床安全应用史的产品积累了较多的临床数据,含有较多公开的临床数据,如临床文献与登记数据库数据,亦包括较多的中长期临床数据,其在真实的临床实践环境中的安全有效性较为确切。
临床数据中如有产品的规格型号、组件、外周血管部位、性能参数、配用器械与满意度、随访通过了解时间、不良事件及并发症等相关内容,建议列表研究。
(五)说明书与标签样稿
说明书与标签样稿应符合《医疗器械说明书与标签管理规定》与相关的国家标准、行业标准的要求。
应包括所有申报的产品组成。应弄清楚设备及附件的有效期及可重复使用次数(若适用)。
机械旋转IVUS弄清楚注射器的要求,若仅可有注册单元内的专用注射器应予以说明,否则应给出配用注射器的要求。
导管应符合YY 0285.1中6.3条款。若产品含有涂层,说明书应弄清楚涂层主要成分、类型及位置。要是预期该器械相对于他器械与/或附件一起使用,因为器械之间的磨擦,应包括足够的信息以标识器械与/或组件的安全组合。同时结合产品实际使用情况建议添加以下内容:
1.建议弄清楚涂层预处理方式与时间,并警告避免将器械预浸泡超出预处理时间,以免影响涂层性能。
2.要是使用不兼容的介质或溶剂(例如酒精或抗菌剂)开展准备可能影响涂层的完整性,建议在说明书中包括注意事项。
3.要是适用,建议就暴露于水性介质中的涂层溶胀行为以及对器械使用的任何影响提供警告或预防措施。
4.建议指示并警告使用者在通过针、金属套管、支架或其他带有尖锐边缘的器械,以及通过曲折或钙化的血管时,应小心操作带有润滑涂层的血管介入器械,以免结果涂层脱落并残留在血管系统中。
5.涂层脱落相关潜在不良事件可能包括但不限于:涂层栓塞部位出现无菌性炎症或肉芽肿、肺栓塞、肺梗塞、心肌栓塞、心肌梗塞、栓塞性中风、脑梗塞、额外的手术干预、组织坏死甚至死亡。
三、参考资料
[1]中华人民共与国国务院.医疗器械监督管理条例:中华人民共与国国务院令第739号[Z].
[2]国家市场监督管理总局.医疗器械注册与备案管理措施:国家市场监督管理总局令第47号[Z].
[3]国家药品监督管理局.医疗器械注册申报资料要求与批准证明文件格式:国家药监局公告2021年第121号[Z].
[4]国家药品监督管理局.医疗器械注册自检管理规定:国家药品监督管理局公告2021年第126号[Z].
[5]国家食品药品监督管理局.医疗器械说明书与标签管理规定:国家食品药品监督管理总局令第6号[Z].
[6]国家食品药品监督管理局.医疗器械通用名称命名规则:国家食品药品监督管理总局令第19号[Z].
[7]国家药品监督管理局.有源手术器械通用名称命名指导原则:国家食品药品监督管理局通告2022年第26号[Z].
[8]国家食品药品监督管理局.医疗器械分类目录:国家食品药品监督管理总局公告2017年第104号[Z].
[9]国家食品药品监督管理局.医疗器械安全与性能基本原则:国家药品监督管理局通告2020年第18号[Z].
[10]国家药品监督管理局.医疗器械产品技术要求编写指导原则:国家药监局通告2022年第8号[Z].
[11]国家药品监督管理局.医疗器械临床评价技术指导原则:国家药监局通告2021年第73号[Z].
[12]国家药品监督管理局医疗器械审评中心.一次性使用输注器具产品注册审查指导原则(2023年修订版):国家药监局器审中心通告2023年第15号[Z].
[13]国家药品监督管理局医疗器械审评中心.医疗器械软件注册审查指导原则(2022年修订版):国家药监局器审中心通告2022年第9号[Z].
[14]国家药品监督管理局医疗器械审评中心.医疗器械网络安全注册审查指导原则(2022年修订版):国家药监局器审中心通告2022年第7号[Z].
[15]国家药品监督管理局.有源医疗器械使用期限注册技术审查指导原则:国家药品监督管理局通告2019年第23号[Z].
[16]国家药品监督管理局.医疗器械动物试验研究注册审查指导原则 第一部分:决策原则(2021年修订版):国家药品监督管理局通告2021年第75号)[Z].
[17]国家药品监督管理局.医疗器械动物试验研究注册审查指导原则 第二部分:试验设计、实施质量保证:国家药品监督管理局通告2021年第75号)[Z].
[18]国家药品监督管理局医疗器械审评中心.带有润滑涂层的血管介入器械注册审查指导原则:国家药品监督管理局通告2023年第25号)[Z].
[19]GB 9706.1-2020医用电气设备第1部分:基本安全与基本性能的通用要求[S].
[20]GB/T 14710-2009 医用电器环境要求及试验方法[S].
[21]GB 9706.237-2020医用电气设备 第2-37部分:超声诊断与监护设备的基本安全与基本性能专用要求[S].
[22]YY 9706.102-2021医用电气设备 第1-2部分:基本安全与基本性能的通用要求 并列标准:电磁兼容 要求与试验[S].
[23]YY 0285.1-2017 血管内导管 一次性使用无菌导管 第1部分 通用要求[S].
[24]YY/T 1659-2019 血管内超声诊断设备通用技术要求[S].
[25]GB 10152-2009 B型超声诊断设备[S].
[26]YY/T 1057-2016医用脚踏开关通用技术条件[S].
[27]GB 15810-2019,一次性使用无菌注射器[S].
[28]GB/T 16886.1-2022,医疗器械生物学评价 第 1部分:风险管理过程中的评价与试验[S].
附件1 血管内超声诊断产品简介
一、工作原理及结构组成
血管内超声诊断系统通过导管技术将微型超声探头送入血管腔内,利用超声波成像原理,对血管内的结构与组织开展成像,并基于图像开展测量与研究。通常由主机、回撤马达或患者接口单元(PIU)、导管三个主要部分组成。回撤马达或患者接口单元(PIU)是驱动导管扫描成像的部件,通常作为主机的一部分。使用中因为距离手术无菌区更近,需要使用无菌袋将导管体外部分与患者接口单元包裹起到无菌屏障作用。
(一)可归结成两种扫描模式
按照扫描模式不同,血管内超声诊断系统可分为机械旋转式与电子相控阵式。机械旋转式IVUS通过旋转机构带动一个单阵元超声换能器在血管内旋转成像。超声换能器旋转一圈即可得到完整的血管横切面图像,再通过回撤马达带动超声换能器在血管内边旋转边回撤开展螺旋式扫描,就可以得到连续的血管内超声图像。机械旋转式IVUS在旋转过程遇到较大阻力时,可能会结果前端探头旋转速度不均匀,形成不均匀旋转伪像(Nurd)。相控阵式IVUS将多个超声换能器呈环形排列在导管前端,主机通过控制每个换能器的发射与接收,再通过图像处理转为图像,仍然可通过马达带动回撤成像。IVUS的回撤成像及对相关图像后处理在冠脉与外周血管中均为常规使用方式,已上市产品回撤速度从0.5mm/s到10mm/s不等多档。但提高回撤速度,可能结果回撤不均匀(影响图像与测量),帧率下降,帧间距离增大结果信息密度下降等问题,图像质量、成像帧率、回撤速度等需匹配综合考虑。
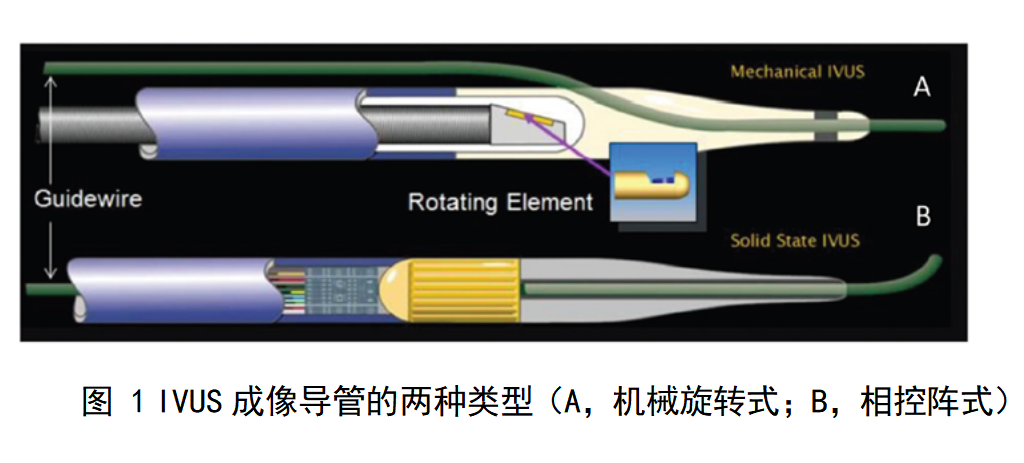
因为机械旋转式IVUS的探头在导管内部旋转,在成像时需要向导管内注入生理盐水排空气体,否则气泡表面形成强超声波反射界面,结果超声波无法传播到血管壁,无法对血管内结构清晰成像,表现为图像变暗。因此附件通常包括注射器,三通阀与延长管。相控阵式导管无需充水排气,不需要这些附件。
(二)性能与功能
IVUS的中心频率与频率带宽决定着系统图像质量。图像分辨率与成像深度与系统的中心频率与频率带宽密切相关,中心频率越高,带宽越大,超声波的波长越短,系统分辨率越高,但高频信号在介质中的衰减快,结果穿透深度越低。相控阵式IVUS受探头组件工艺复杂度以及导管尺寸的限制,难以实现高中心频率,已上市产品最高中心频率为20MHz。而机械旋转式IVUS的探头只需要一个换能器,中心频率可以做到更高,已上市产品最高达到60MHz,且有更高中心频率的机械旋转式IVUS在研发。
IVUS的基础图像处理通常包括管腔抑制、环晕抑制等,而各厂家基于回撤图像开发了大量后处理功能,如回撤方向血管/支架三维重建、血管评估、斑块负荷计算、斑块性质研究、造影配准、基于冠脉IVUS影像的血流储备分数计算等。血管评估包括很多方面,如管腔面积计算、外弹力膜识别、狭窄比、血管分叉识别等。
二、临床应用
血管内超声已成为心血管介入手术的重要工具,因为可以将高频率超声探头放入血管内部成像,可清晰通过了解到血管横截面结构并精准测定管腔、血管直径等,对病变开展量化测量与评估,帮助术者准确判断病变的位置与范围、病变的严重程度及性质等,对介入治疗有较强指导作用,尤其在高危病变、复杂病变中可全流程指导并优化手术方案。
IVUS在介入手术的术前、术中及术后阶段均发挥根本作用:(1)术前规划:精确测量参考血管直径,指导支架尺寸选择;识别斑块性质,决定预处理策略等。(2)术中引导:指导支架落到点选择,评估慢性闭塞病变(CTO)与分叉病变入口等。(3)术后评估:检测支架膨胀程度、贴壁与边缘夹层等,减少支架内血栓风险。
(一)IVUS在冠脉动脉介入治疗的应用
IVUS在经皮冠状动脉介入治疗(PCI)中应用较广泛,尤其是左主干病变、分叉病变、慢性完全闭塞(CTO)病变、钙化病变等冠脉复杂病变(约占所有PCI的50%以上)。在复杂病变场景下,冠脉造影因为图像分辨率、造影体位等局限性,存在一定的评估难度,需要IVUS等信息更丰富的腔内影像工具辅助决策。
关于IVUS在复杂病变指导PCI的临床价值的临床研究及结论已积累充分的循证医学支持。近两年,欧洲与美国临床指南与专家共识提高了对IVUS的临床使用及复杂病变中的应用推荐等级。
(二)IVUS在外周血管介入治疗的应用
外周血管介入治疗中的IVUS应用比例仍比较低,然而随着相关研究的积累,IVUS指导外周血管介入治疗的价值已比较弄清楚,尤其是在下肢动脉、主动脉、颈动脉、髂静脉等外周血管疾病中的应用。
(三)IVUS的风险与并发症
IVUS导管的应用方式相对于他血管介入导管一致,相关并发症类型与出现概率也基本一致,主要包括冠状动脉痉挛、夹层、血管穿孔、导丝缠绕、远端栓塞等,相关研究表明IVUS组相比单造影组严重并发症(死亡/心梗/急诊手术)出现率没有显著增加,且严重并发症均与操作本身(如球囊过度扩张)相关,总体收益显著相较而言更多风险。



 1409
1409

