一、产品概述
(一)产品结构及组成
分支型主动脉术中支架系统由带有分支的支架及输送器组成。其中支架由覆有PTFE膜的镍钛合金支架、不锈钢连接套管、PET管状涤纶布(带标识线)及包膜缝线、人造血管、聚四氟乙烯的缝合线、包膜、包膜固定线组成。人造血管材质为PET、胶原、甘油。输送器由大软管、小软管、释放旋钮等部件组成,其中释放旋钮通过释放拉线分别连接支架的不同位置,可使支架分段释放。产品一次性使用,经环氧乙烷灭菌,有效期3 年。
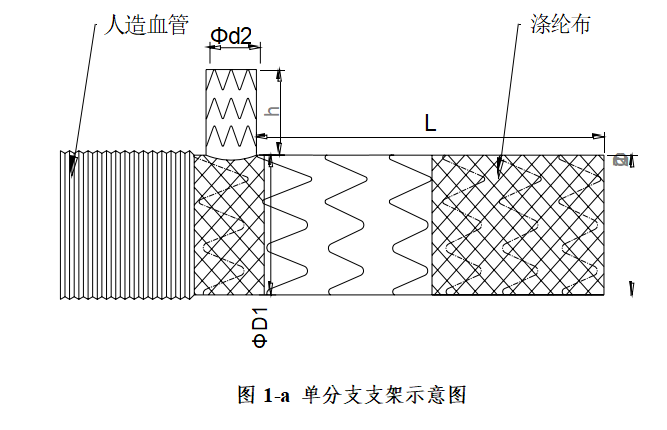
支架结构示意图如图1:
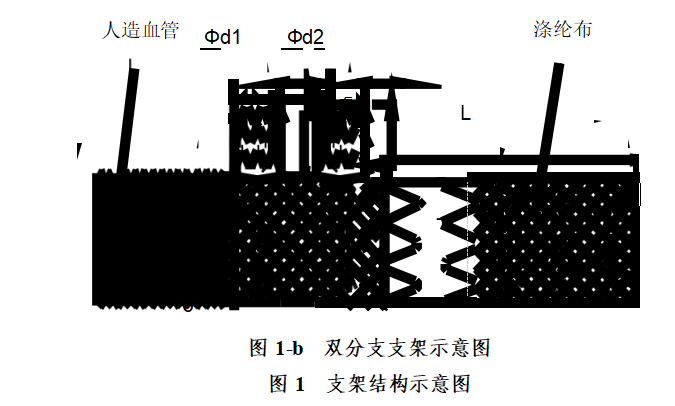
支架及输送器整体结构示意图如图2:
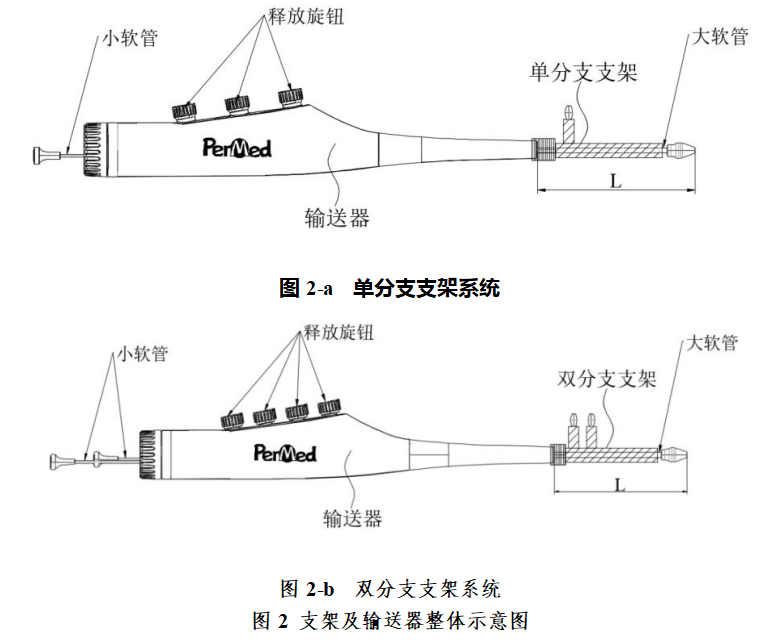
(二)产品适用范围
该产品适用于StanfordA型主动脉夹层的外科开放手术治疗。
(三)型号/规格
产品型号规格见表1。
表1 产品型号规格表
支架类型 | 主体支 架近端外径 D1 | 主体支 架远端外径 D2 | 左颈总动脉分支 支架外径 d1 | 左锁骨下动脉分 支支架外径 d2 | 分支支架高度 h | 主体支架长度 L |
直管型 | 20 | 20 | 06/08/10/12/14 | 08/10/12/14 | 20/25/30 | 100/105/1 10/115/12 0 |
22 | 22 | |||||
24 | 24 | 06/08/10/12/14/16 | 08/10/12/14/16 | |||
26 | 26 | |||||
锥度型 | 20 | 18 | 06/08/10/12/14 | 08/10/12/14 | ||
22 | 20 | |||||
24 | 22 | 06/08/10/12/14/16 | 08/10/12/14/16 | |||
26 | 24 | |||||
28 | 26 | 08/10/12/14/16 | 08/10/12/14/16 | 25/30 | ||
28 | 24 | |||||
30 | 28 | |||||
30 | 26 | |||||
32 | 30 | 10/12/14/16 | 10/12/14/16 | |||
32 | 28 | |||||
34 | 32 | |||||
34 | 30 | |||||
36 | 34 | |||||
36 | 32 |

(四)工作原理
分支型术中支架系统由带有分支的支架及输送器组成,用于在外科开放手术中治疗A型主动脉夹层。使用时在外科手术条件下,先将主动脉切开,然后通过输送器将分支型支架从升主动脉或主动脉弓部的切口送入预期位置,其中主体支架用于重建主动脉弓及降主动脉,双分支支架的两个分支支架分别用于重建左颈总动脉与左锁骨下动脉,单分支支架的分支支架用于重建左锁骨下动脉,最后将主体支架近端的人工血管端口与升主动脉或人工血管开展吻合后恢复血流,即完成手术。
二、临床前研究概述
(一)产品性能研究
1.产品技术要求研究
产品技术要求研究项目如表2 所示。
表2 产品技术要求研究摘要
序号 | 研究项目 | 验证结论 | |
1 | 带分支的支架 | 外观 | 合格 |
尺寸 | 合格 | ||
支架相变温度 | 合格 | ||
支架贴壁性 | 合格 | ||
径向支撑力 | 合格 | ||
支架回弹性 | 合格 | ||
释放力 | 合格 | ||
加工吻合强度 | 合格 | ||
整体水渗透性 | 合格 | ||
覆膜破裂力 | 合格 | ||
轴向拉伸强度 | 合格 | ||
血流阻断性 | 合格 | ||
支架长度与直径关系 | 合格 | ||
人造血管轴向拉伸强度 | 合格 | ||
人造血管周向拉伸强度 | 合格 | ||
人造血管探头破裂强度 | 合格 | ||
人造血管缝线牵拉强度 | 合格 | ||
人造血管单位面积重量 | 合格 | ||
支架弯曲打折 | 合格 | ||
人造血管水渗透性 | 合格 | ||
支架与输送器分离力 | 合格 | ||
PTFE 膜的水渗透压 | 合格 | ||
支架-重金属 | 合格 | ||
支架(不包括人造血管部分)- 酸碱度 | 合格 | ||
支架(不包括人造血管部分)- 紫外吸光度 | 合格 | ||
支架(不包括人造血管部分)- 还原物质 | 合格 | ||
支架(不包括人造血管部分)- 蒸发残渣 | 合格 | ||
胶原蛋白含量 | 合格 | ||
2 | 输送器 | 外观 | 合格 |
尺寸 | 合格 | ||
连接强度 | 合格 | ||
扭转结合强度 | 合格 | ||
末端头端 | 合格 | ||
重金属 | 合格 | ||
酸碱度 | 合格 | ||
紫外吸光度 | 合格 | ||
还原物质 | 合格 | ||
蒸发残渣 | 合格 | ||
3 | 支架系统 | 外观 | 合格 |
尺寸 | 合格 | ||
模拟使用 | 合格 | ||
微粒污染 | 合格 | ||
环氧乙烷残留量 | 合格 | ||
无菌 | 合格 | ||
细菌内毒素 | 合格 |
2.产品性能评价
除产品技术要求性能外,产品性能研究还包括:包膜尺寸、连接套管与镍钛丝连接强度、包膜缝合点撕裂强度、有限元研究、疲劳耐久性、MRI兼容性、可视性、镍钛合金化学成分、显微结构、覆膜剥离力、压缩前后支架长度变化率、支架形状改变率、镍离子析出、人造血管胶原涂层降解性能的验证。上述研究结果表明,产品性能符合设计输入要求。
(二)生物相容性
该产品由支架与输送器组成,其中支架为植入器械,与循环血液持久接触;输送器为外部接入器械,与人体短期接触。申请人按照GB/T 16886 系列标准对支架与输送器分别开展了生物相容性评价,评价结果表明,产品生物相容性风险可接受。具体评价项目见表3。
表3生物学相容性评价表
项目 | 支架 | 输送器 |
细胞毒性 | √ | √ |
皮肤致敏 | √ | √ |
皮内反应 | √ | √ |
急性全身毒性 | √ | √ |
热原 | √ | √ |
溶血 | √ | √ |
凝血 | / | √ |
血栓形成 | √ | √ |
遗传毒性 | √ | / |
亚慢性全身毒性 | √ | / |
肌肉植入 | √ | / |
亚急性全身毒性 | √ | / |
慢性全身毒性 | √ | / |
致癌性 | √ | / |
(三)生物安全性
申请人按照《动物源性医疗器械注册技术审查指导原则》要求,提交了针对人造血管胶原蛋白涂层的免疫原性与病毒灭活性能评价资料。评价结果证明,申报产品的生物安全性风险可接受。
(四)灭菌
该产品按照基于环氧乙烷灭菌,无菌状态提供。申请人提供了灭菌确认报告,证明无菌保证水平为 10-6。环氧乙烷残留量不相较而言更多10μg/g,2-氯乙醇残留量不相较而言更多9mg/套。
(五)产品有效期与包装
该产品有效期为三年。申请人提供了货架有效期验证报告。验结论显示验为加速老化与实时老化,包括产品稳定性、包装完整性与运输模拟验证。
(六)动物研究
申请人开展了猪模型的动物试验研究,以评价产品在动物应用中的安全、可行性。通过DSA造影、CT数据、大体解剖通过了解、组织病理及胶原蛋白染色等方式,评价了器械植入后的安全性、可行性;通过操作评价表方式验证了器械植入过程中的可操作性。动物试验结果表明,产品符合预期设计要求。
申请人选择临床试验路径开展临床评价,临床试验的目的为评价申报产品在治疗StanfordA型主动脉夹层中的安全性与有效性。
临床试验在 16 家临床机构开展,针对双分支结构的术中支架系统开展前瞻性、多中心、随机对照研究,对照器械为国内已上市术中支架系统(国械注准 20193131889),共计入组214 例受试者,试验组107 例,对照组107 例。其中,214 例纳入FAS集,212 例纳入PPS集(试验组107 例,对照组 105例),214例纳入SS集。单分支结构的术中支架系统共计入组32 例受试者,其中,32 例接受治疗纳入FAS集,31 例纳入PPS集,32 例纳入SS集。
临床试验的主要评价指标为术后 12 个月全因死亡率。次要评价指标为器械植入成功率、手术成功率、术后 30 天死亡率、术后6 个月/12 个月假腔血栓化、术后12 个月分支通畅率、术后 12 个月靶病变二次干预率;安全性评价指标为卒中出现率、脊髓缺血出现率、急性肾损伤出现率、主动脉夹层相关死亡率、器械相关不良事件出现率。
随机对照研究结果为:
主要评价指标术后 12个月全因死亡率在FAS集中,试验组为 5.6%,对照组为14.0%,组间差值及其 95%CI为-8.4%(-16.80%,-0.31%),组间率差的 95%CI上限小于设定的非劣效界值,非劣效要是成立。PPS集中,试验组为5.6%,对照组为14.3%,组间率差及其95%CI为-8.7%(-17.18%,-0.52%)。组间差异的95%CI上限小于设定的非劣效界值。
次要评价指标中器械成功率,手术成功率,术后30 天死亡率,术后6 个月/12 个月假腔血栓化,术后12 个月靶病变二次干预率,组间均无统计学差异;术后 12 个月试验组分支通畅率为92.6%。结果详见表4。
表4 次要评价指标结果
次要评价指标 | 试验组 | 对照组 | |
器械成功率 | 100% | 100% | |
手术成功率 | 100% | 100% | |
术后30天死亡率 | 3.7% | 10.3% | |
术后6 个月假腔血栓化情况 | 完全血栓化 | 67.4% | 74.1% |
部分血栓化 | 28.4% | 23.5% | |
未血栓化 | 4.2% | 2.4% | |
术后12 个月假腔血栓化情况 | 完全血栓化 | 73.4% | 76.3% |
部分血栓化 | 22.3% | 22.5% | |
未血栓化 | 4.3% | 1.3% | |
术后12 个月靶病变二次干预率 | 1.9% | 0% | |
术后12 个月分支通畅率 | 92.6% | / | |
安全性评价指标中卒中出现率试验组 2.8%,对照组15.0%,P=0.0018,组间有统计学差异;脊髓缺血出现率,急性肾损伤出现率,主动脉夹层相关死亡率,器械相关不良事件出现率,组间均无统计学差异。不良事件出现率,组间均无统计学差异;严重不良事件出现率,P=0.0082,组间有统计学差异。详见表5。
表5 安全性评价指标结果
安全性评价指标 | 试验组 | 对照组 |
卒中出现率 | 2.8% | 15.0% |
脊髓缺血出现率 | 1.9% | 2.8% |
急性肾损伤出现率 | 14.0% | 16.8% |
主动脉夹层相关死亡率 | 4.7% | 10.3% |
器械相关不良事件出现率 | 14.0% | 8.4% |
不良事件出现率 | 79.4% | 87.9% |
严重不良事件出现率 | 23.4% | 40.2% |
单分支结构的术中支架系统试验结果为:主要评价指标术后12 个月全因死亡率的FAS集为9.4%,PPS集为9.7%;次要评价指标详见表 6,安全性评价指标、不良事件出现率及严重不良事件出现率详见表7。
表6 次要评价指标结果
次要评价指标 | 单分支结构 | |
器械成功率 | 100% | |
手术成功率 | 100% | |
术后30天死亡率 | 9.4% | |
术后6 个月假腔血栓化情况 | 完全血栓化 | 71.4% |
部分血栓化 | 25.0% | |
未血栓化 | 3.6% | |
术后12 个月假腔血栓化情况 | 完全血栓化 | 84.2% |
部分血栓化 | 15.8% | |
未血栓化 | 0% | |
术后12 个月靶病变二次干预率 | 0% | |
术后12 个月分支通畅率 | 100% | |
表7 安全性评价指标结果
安全性评价指标 | 单分支结构 |
卒中出现率 | 9.4% |
脊髓缺血出现率 | 3.1% |
急性肾损伤出现率 | 15.6% |
主动脉夹层相关死亡率 | 9.4% |
器械相关不良事件出现率 | 12.5% |
不良事件出现率 | 71.9% |
严重不良事件出现率 | 28.1% |
综上,申请人提供的临床评价资料符合目前的临床审评要求。
四、产品受益风险判定
经综合评价,在目前认知水平上,认为该产品上市带来的获益/受益相较而言更多风险,为保证用械安全,需在说明书中提示以下信息。
(一)警告
1.请仔细阅读所有使用说明及注意事项,如不依照此说明操作将给患者造成严重的伤害;
2.器械仅限于具有主动脉外科手术经验的医师使用(包括接受过此器械培训的医师);
3.术前应按照 CT测量数据,备好相应型号的分支型主动脉术中支架系统;
4.建议主体支架的直径应不相较而言更多正常血管直径的 20%,分支支架的尺寸应尽量贴合分支开口上方2~3cm处对应血管直径,最大不得相较而言更多分支开口上方 2~3cm处对应血管直径的3mm;
5.使用前检查并确定没有出现因为运输而结果的包装损坏,要是产品包装损坏、器械损坏或存在灭菌失效的风险,请不要使用产品并将其返回给北京市普惠生物医学工程有限公司。在使用前,请再次核查本产品的型号与尺寸符合医生所指定病人的需要;
6.本产品为一次性使用,拆包后不能二次灭菌消毒使用;
7.纸盒内产品包装共三层,第一层内部为非无菌状态,需由非无菌操作人员拆至最内层的吸塑盒包装,方可放在无菌手术台上;
8.术中应确保支架植入血管真腔,且支架已完全打开;
9.本产品不推荐相对于他支架重叠使用。
(二)禁忌证
1.椎动脉变异的患者;
2.严重的急性全身感染者;
3.多器官功能衰竭的患者;
4.不能耐受麻醉及体外循环的受试者;
5.严重灌注不良综合征的患者(如出现因缺血所致的昏迷、截瘫、需要透析、胃肠道坏死或肢体坏死等);
6.左颈总动脉分支血管直径<5mm或>16mm的患者不宜使用双分支支架;
7.左颈总动脉与左锁骨下动脉间距<4mm或>12mm患者不宜使用双分支支架;
8.主动脉弓上分支畸形的患者不宜使用双分支支架;
9.左锁骨下动脉分支血管直径<7mm或>16mm的患者不宜使用本产品;
10.对聚酯纤维、聚四氟乙烯、不锈钢、镍钛合金与牛源材料过敏患者。



 1444
1444

