1.文档介绍
文档介绍
本指南编写目的在于弄清楚粤港澳大湾区内地临床急需进口港澳药械流通管理系统数据采集接口的对接要求,为接入单位的信息系统开发人员提供清晰、规范的技术说明与操作指引,确保各方能高效、准确地完成接口对接,实现进口药械流通数据的及时上报与有效监管,助力粤港澳大湾区药械管理工作的规范化与智能化。
编写范围
本指南的编写范围涵盖粤港澳大湾区内地临床急需进口港澳药械流通管理系统数据采集接口的系统介绍、接口规范、数据报送要求、对接流程、技术参数及常见问题处理等内容,为接入单位与本系统之间开展数据对接、上传及维护工作提供全面的技术依据与操作指导。
适用对象
本指南适用于参与粤港澳大湾区内地临床急需进口港澳药械流通管理系统数据采集与报送的药械经营企业管理人员、指定医疗机构管理人员以及负责相关信息系统开发、对接与运维的技术人员。
参考文档
《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》
《粤港澳大湾区内地临床急需进口港澳药械流通管理系统数据采集接口规范(2025年修订版)》
名词解释
名词术语 | 解释 |
粤港澳大湾区内地九市 | 指广东省行政区域内广州、深圳、珠海、佛山、惠州、东莞、中山、江门、肇庆九个城市。 |
临床急需进口港澳药品医疗器械( 临床急需港澳药械) | 指经广东省相关主管部门审核,允许在内地九市指定医疗机构进口使用的临床急需、已在港澳地区上市的药品或港澳公立医院已采购使用、具有临床应用先进性的医疗器械。 |
药械经营企业 | 依法取得药品/医疗器械经营许可证与进出口经营资质,承担急需港澳药械进口、贮存与配送等活动的企业。 |
指定医疗机构 | 经广东省卫生健康主管部门审核确认,具备相关条件,被授权可进口与使用急需港澳药械的医疗机构。 |
数据采集接口 | 用于实现药械经营企业、指定医疗机构与粤港澳大湾区临床急需进口港澳药械流通管理系统之间数据自动采集、上传、校验与反馈的数据交互接口。 |
接入单位 | 接入单位包括药械经营企业及指定医疗机构。 |
企业专属网页 | 指由广东省药品监督管理局面向药品、医疗器械、化妆品相关企业及从业人员设立的专属业务服务入口,该网页提供统一的登录访问渠道,具备办理待办事项、接收消息通知、开展业务办理、开展数据报送与查询、管理企业档案等功能,为企业及从业人员提供高效、便捷、集成化的业务服务。 |
企业内部系统 | 由接入单位自行建设,实现临床急需进口港澳药械流通数据采集、管理与报送等功能的信息化系统。 |
追溯码 | 指为急需港澳药械赋予的唯一标识代码,以此实现药械采购、进口、贮存、配送、使用等全过程信息追溯与监管。 |
批件 | 由省药品监督管理部门核发的,允许指定医疗机构进口与使用特定急需港澳药械的批准文件。 |
文档介绍
系统建设背景
粤港澳大湾区内地的港澳居民人口众多,便捷就医呼声强烈,《粤港澳大湾区药品医疗器械监管创新发展工作方案》让安全有效的创新医疗产品更便捷地在粤港澳大湾区内地指定医疗机构使用,解决了粤港澳大湾区内地的港澳居民因医疗需求频繁往来粤港澳三地的实际问题,更好地保障港澳居民身体健康与生命安全。
按照《粤港澳大湾区药品医疗器械监管创新发展工作方案》的要求,广东省药监局不断改进粤港澳大湾区临床急需进口药械流通管理系统,对大湾区临床急需药械开展采购、进口、贮存、配送、使用全过程管理,努力实现来源可溯、去向可追、风险可控、责任可究,助力区域医疗创新与公共健康治理现代化。
为进一步提升临床急需港澳药械管理的规范化与法治化,2024年7月31日,广东省通过并发布了《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》,自2024年12月1日起施行。该条例弄清楚了急需港澳药械采购、进口、贮存、配送、使用及全过程监督管理的法律依据,要求形成健全药械全过程追溯体系,推动全流程信息化、智能化监管,有效保障粤港澳大湾区居民的用药用械安全与健康权益。
业务目标
落实国家与广东省关于粤港澳大湾区临床急需进口港澳药械管理的相关政策与法规要求,形成覆盖采购、进口、贮存、配送、使用等环节的全过程数据采集与流通管理平台。通过为药械经营企业与指定医疗机构提供标准化、智能化的数据采集接口,实现企业内部系统与监管系统的数据互联互通,保障数据的及时、准确、完整上报,支持药械全流程的溯源与监管。同时,推动实现急需港澳药械来源可溯、去向可追、风险可控、责任可究,提升区域药械流通管理的科学化、规范化与智能化水平,助力粤港澳大湾区医疗服务高质量发展与居民健康保障。
系统结构及功能描述
粤港澳大湾区临床急需进口药械流通管理系统面向企业使用的功能主要分为数据采集接口与粤港澳大湾区临床急需进口药械流通管理系统企业端两部分。
数据采集接口作为粤港澳大湾区临床急需进口药械流通管理系统接收企业报送粤港澳大湾区临床急需进口药械流通数据入口之一,主要提供企业内部系统直连报送业务数据的服务。本次升级将为药械经营企业、使用单位提供临床急需进口药械流通数据的报送接口,由这些单位将药械进口信息、药械追溯码及箱包关系信息、药械收货信息、药械发货信息、药械库存信息、药械使用信息报送至粤港澳大湾区临床急需进口药械流通管理系统。
粤港澳大湾区临床急需进口药械流通管理系统企业端,通过广东省药品监督管理局的企业专属网页(https://qy.gdfda.gov.cn/)登录进入。
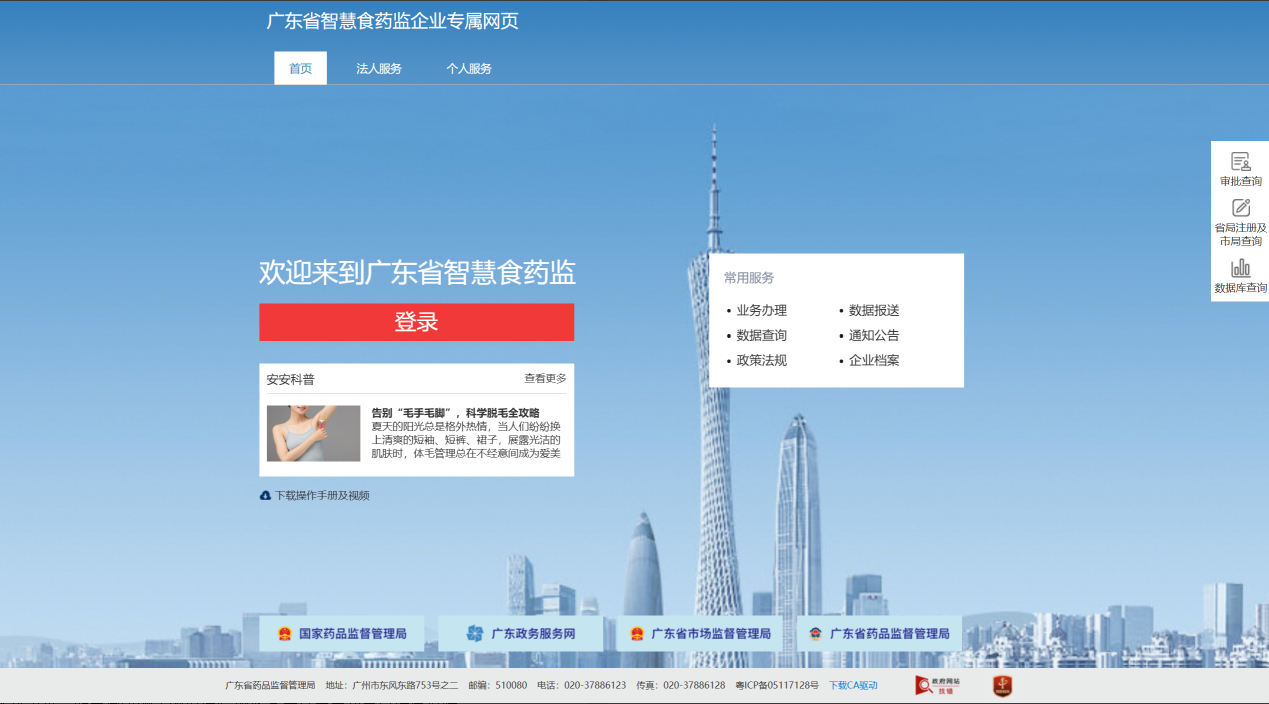
在【数据报送】-【粤港澳大湾区内地临床急需进口药品数据报送】可查看接入单位自身报送的相关数据以及查询数据解析情况。

业务规则
用户身份验证
系统按照企业或医疗机构用户在广东省统一身份认证平台的账号实名核验等级判断有效性,企业或医疗机构用户必须具备账号可信等级四级(L2)及以上方可访问系统。具体实名核验等级说明请参考广东省统一身份认证平台帮助文档:https://tyrz.gd.gov.cn/pscp/sso/static/help
数据校验
数据校验即将企业报送业务数据需符合以下校验规则,无法匹配的视为校验不通过:
1.药械批件的校验
以药械的批件号完全匹配作为药械批件的匹配依据;
2.药械品种的校验
药品:以药品名称(中文)+剂型+规格+包装规格+生产厂商完全匹配作为品种的匹配依据;
医疗器械:以医疗器械名称(中文)+型号+规格+包装规格(如有)+生产厂商完全匹配作为品种的匹配依据;
3.药械收/发货机构的校验
以药械收/发货机构统一社会信用代码完全匹配作为收发货单位的匹配依据;
4.追溯码重复校验
企业报送业务数据中,追溯码完全匹配作为匹配依据;
进口信息中已经存在的追溯码不能再次导入;
单次导入事件中存在重复的追溯码不能再次导入;
对于校验不通过的数据,系统将不予入库,企业需核对后重新上传。
数据报送
企业上报文件前必须先在广东省药品监督管理局的企业专属网页登录,以保障数据有效性及合法性;
企业通过接口上传的数据中数量不允许出现负数;
企业通过接口上传的数据中数据类型为字典值的数据必须使用接口规范中的字典值;
企业如发现数据错误,需通过登录粤港澳大湾区临床急需进口药械流通管理系统企业端开展数据删除操作,删除成功后重新报送正确的数据。
系统入口
练习环境服务器入口
企业专属网页(大湾区临床急需进口药械流通管理系统企业端的入口):
https://lx.gdfda.gov.cn/eportal/
数据采集接口(药品批件数据上报):
https://lx.gdfda.gov.cn/drugdwqreport/{请求入口}
数据采集接口(医疗器械批件数据上报):
https://lx.gdfda.gov.cn/equipmentdwqreport/{请求入口}
生产环境服务器入口
企业专属网页(大湾区临床急需进口药械流通管理系统企业端的入口):
https://qy.gdfda.gov.cn/
数据采集接口(药品批件数据上报):
https://qy.gdfda.gov.cn/drugdwqreport/{请求入口}
数据采集接口(医疗器械批件数据上报):
https://qy.gdfda.gov.cn/equipmentdwqreport/{请求入口}
数据采集内容
参见《粤港澳大湾区内地临床急需进口港澳药械流通管理系统数据采集接口规范(2025年修订版)》。
对接步骤
前期准备
1.账号的初始化
登录一次企业专属网页,系统自动完成用户数据初始化,在《我的档案》菜单下获取上报的授权码(TOKEN)。
2.阅读技术文档
阅读本开发指南及《粤港澳大湾区内地临床急需进口港澳药械流通管理系统数据采集接口规范(2025年修订版)》,了解系统开发范围及相关业务、技术细节。
内部系统开发
为实现与数据采集接口对接,企业内部系统需实现的主要功能如下:
l标准HTTPS数据通讯;
l企业内部系统业务单据[进口、发货、收货、使用、库存等],需按照接口规范要求以HTTPS标准格式整合数据文件
l接口上报对接
涉及数据采集接口的具体技术规范请查阅《粤港澳大湾区内地临床急需进口港澳药械流通管理系统数据采集接口规范(2025年修订版)》。
系统联调
系统联调分为以下两步:
步骤一:测试企业内部系统与数据采集接口交互的准确性与有效性。
步骤二:通过企业内部系统与数据采集接口测试入口交互,并登录企业专属网页进入粤港澳大湾区临床急需进口药械流通管理系统企业端检查通过接口报送的数据,从而验证对接是否成功。
数据报送要求
粤港澳大湾区急需进口药械流通监管系统作为急需进口药械全流程监管数据的唯一指定报送平台。药械经营企业与指定医疗机构需依据监管部门要求,建设改进的内部数据管理系统,确保相关数据及时、真实、准确、完整地采集并通过对接接口与监管系统实时报送相关数据。
药械经营企业数据报送
药械经营企业应当通过监管系统及时、如实报送急需进口药械在进口、收发货、储存等环节的各项数据,主要包括进口信息(需包括产品“一物一码”追溯标识及各级包装编码关系)、发货信息、库存盘点信息与退货收货信息(即指定医疗机构退货数据)。企业对报送数据的真实性、准确性、完整性负责,若发现数据有误,须按照规定及时开展更正并补报。
指定医疗机构数据报送
指定医疗机构应当通过监管系统及时、如实报送急需进口药械在收货、使用、库存盘点与退货发货等环节的数据,确保所报数据能够真实反映药械在本机构内的流转、使用与库存实际情况。指定医疗机构还应按照国家密切相关规定,做好急需进口药械的使用记录、病历管理以及原始凭证与相关资料的保存,以备监管部门查验。
报送时限要求
药械经营企业与指定医疗机构需在进口、收货(含退货)、发货(含退货)、使用等业务完成后,第一时间将相关数据上传至监管系统,原则上应实时报送,如遇特殊情况最迟不得超过24小时。库存盘点数据应每30天至少报送一次,并在盘点结束后24小时内上传。每月结束后5个工作日内,须完成对当月数据报送情况的自查,确保所有应报数据齐全且准确。
数据管理与合规要求
药械经营企业与指定医疗机构应当形成健全数据管理制度,弄清楚专门部门与人员负责数据采集、审核与报送工作。报送的数据必须真实、准确、完整、及时,不得谎报、瞒报、漏报、迟报或篡改数据。所有采购、进口、贮存、配送、使用等环节的原始凭证、票据与记录资料都要妥善保存,保存期限须符合国家相关规定。
联系我们
如在系统对接及数据报送过程中遇到技术问题可联系技术支持团队。
QQ群:1037110086
电子邮箱:liuji@caseeder.com
工作时间:周一至周五 9:00-18:00



 1483
1483

