【产品名称】
通用名称:α 与β 地中海贫血基因检测试剂盒(单分子测序法)
【包装规格】
建库试剂:产品编号R1010,规格:96 人份/盒
测序试剂:产品编号R4001,规格:1次反应/测试,1 测试/盒。
【预期用途】
本产品用于体外定性检测人外周静脉全血样本中的地中海贫血基因突变,包括α-珠蛋白基因的4 种缺失:--SEA、-α3.7、 -α4.2 与--THAI ;3 种点突变:αCSα(HbCS)、αQSα(Hb QS)与αWSα(Hb Westmead)及β-珠蛋白基因的16 种点突变:-30(T>C)、-32(C>A)、-28(A>G)、-29(A>G)、Cap+40-43(-AAAC)、Initiationcodon(ATG>AGG)、CD14/15(+G)、CD17(AAG>TAG)、CD26(GAG>AAG)、CD27/28(+C)、CD41/42(-TTCT)、CD43(GAG>TAG)、CD71/72(+A)、IVS-I-1(G>T)、IVS-I-5(G>C)、IVS-II-654(C>T)。其对应的HGVS 命名见下表。
表1.试剂盒范围内的23 种突变与HGVS 命名对应表
基因 | 突变类型 | HGVS 命名 |
α-珠蛋白基因 | SEA-- | / |
-α3.7 | / | |
-α4.2 | / | |
THAI-- | / | |
αCSα(Hb CS) | HBA2:c.427T>C | |
αQSα(HbQS) | HBA2:c.377T>C | |
αWSα(Hb Westmead) | HBA2:c.369C>G | |
β-珠蛋白基因 | -30(T>C) | HBB:c.-80T>C |
-32(C>A) | HBB:c.-82C>A | |
-28(A>G) | HBB:c.-78A>G | |
-29(A>G) | HBB:c.-79A>G | |
Cap+40-43(-AAAC) | HBB:c.-11_-8delAAAC | |
Initiation codon(ATG>AGG) | HBB:c.2T>G | |
CD14/15(+G) | HBB:c.45_46insG | |
CD17(AAG>TAG) | HBB:c.52A>T | |
CD26(GAG>AAG) | HBB:c.79G>A | |
CD27/28(+C) | HBB:c.84_85insC | |
CD41/42(-TTCT) | HBB:c.126_129delCTTT | |
CD43(GAG>TAG) | HBB:c.130G>T | |
CD71/72(+A) | HBB: c.216_217insA | |
IVS-I-1(G>T) | HBB:c.92+1G>T | |
IVS-I-5(G>C) | HBB:c.92+5G>C | |
IVS-II-654(C>T) | HBB:c.316-197C>T |
本试剂盒用于α-与β-地贫的辅助诊断(遗传诊断),检测结果不作为患者临床诊断的唯一依据,仅供临床参考。
地中海贫血(简称地贫)是一种常染色体隐性遗传病,是因为珠蛋白基因出现突变(包括点突变与缺失等),致使珠蛋白肽链合成减少或完全不能合成而结果的一组单基因遗传性溶血性疾病[1],轻者可无临床表现,重者以开展性溶血性贫血为主要特征。按照珠蛋白肽链合成受到抑制的类型,地贫分为α-,β-与γ-地贫等,临床上最常见的是α-与β-地贫。地贫主要分布在地中海沿岸、东南亚与少数非洲地区,具有显著的种族特性与地域分布差异。地贫是我国南方地区最常见、危害最大的遗传病之一,尤以广西、云南、广东、海南、四川与贵州等省份为甚,云南、海南与广东的地贫基因人群携带率可达10%以上,广西更是达到了20%以上。α 地贫又分为α+(单条染色体上1 个α 基因出现缺失)与α0(单条染色体上两个α 基因均缺失)地贫[1,2],β 地贫分为β0、β+与β++地贫。α 地中海贫血是因为α 珠蛋白基因缺失或缺陷结果α 珠蛋白链的合成受到部分或完全抑制而引起的遗传性溶血贫血,编码α 珠蛋白链的基因是16号染色体短臂末端的 α珠蛋白基因簇。就人类正常基因组而言,正常个体16号染色体上均有2 个α 珠蛋白基因(α2 基因与α1 基因),1 个α 基因缺失者为α+地贫(-α/αα),2 个α 基因缺失者为α0地贫(--/αα)。按照造成α 地贫的分子基础可将α 地贫分为缺失型与非缺失型,其中95%以上是因为α 珠蛋白基因大片段缺失所致,为缺失型。目前全球至少发现了35 种α 基因缺失,我国最常见的为--SEA、-α3.7 与-α4.2缺失型突变与非缺失型α 地贫[αWS(CD122),CAC>CAG;αQS(CD125),CTG>CCG;αCS( CD142 ),TAA>CAA][2,3],其中,--SEA突变类型最常见。另外,泰国型(--THAI) 缺失也是我国南方人群存在的缺失类型,在台湾、广东、广西、云南及福建等地均有报道[4,5],且部分地区该型缺失的携带率较高(如广西地区携带率为0.6%)[6]。β 地中海贫血是最常见的单基因遗传病之一,β 珠蛋白基因簇位于人体11号染色体的短臂上,β 珠蛋白链由β 珠蛋白基因所编码的146 个氨基酸组成。β 地中海贫血的主要分子病理学基础是β珠蛋白基因的点突变及小的插入或缺失,结果β珠蛋白基因转录、hnRNA 加工或mRNA 翻译异常,相对过剩的α 珠蛋白肽链是β 地中海贫血出现溶血、贫血与无效造血的根本原因。中国人群中β 地中海贫血以突变型地贫为主,其基因型主要有CD41/42、IVS-Ⅱ-654、-28、CD71/72、CD17、CD26、CD27/28、IVS -Ⅰ-1、CD43、- 32、-29、-30、-CD14/15、Cap+40-43、IntCD 与IVS-Ⅰ-5[7]。现在对地贫筛查方法有红细胞渗透脆性试验、血常规参数检测研究、血红蛋白电泳试验等。地中海贫血的分子诊断方法中,缺失类型检测方法主要是跨越断裂点 PCR(GAP-PCR)、实时PCR、多重连接探针扩增(MLPA)与微阵列比较基因组杂交(comparative genomichybridization,array-CGH)[8]。非缺失检测方法主要是反向点杂交(RDB)[9]、基于实时PCR的荧光标记探针的熔解曲线研究法(PCR melting curve analysis,PMCA)与Sanger 测序[9]。
【检验原理】
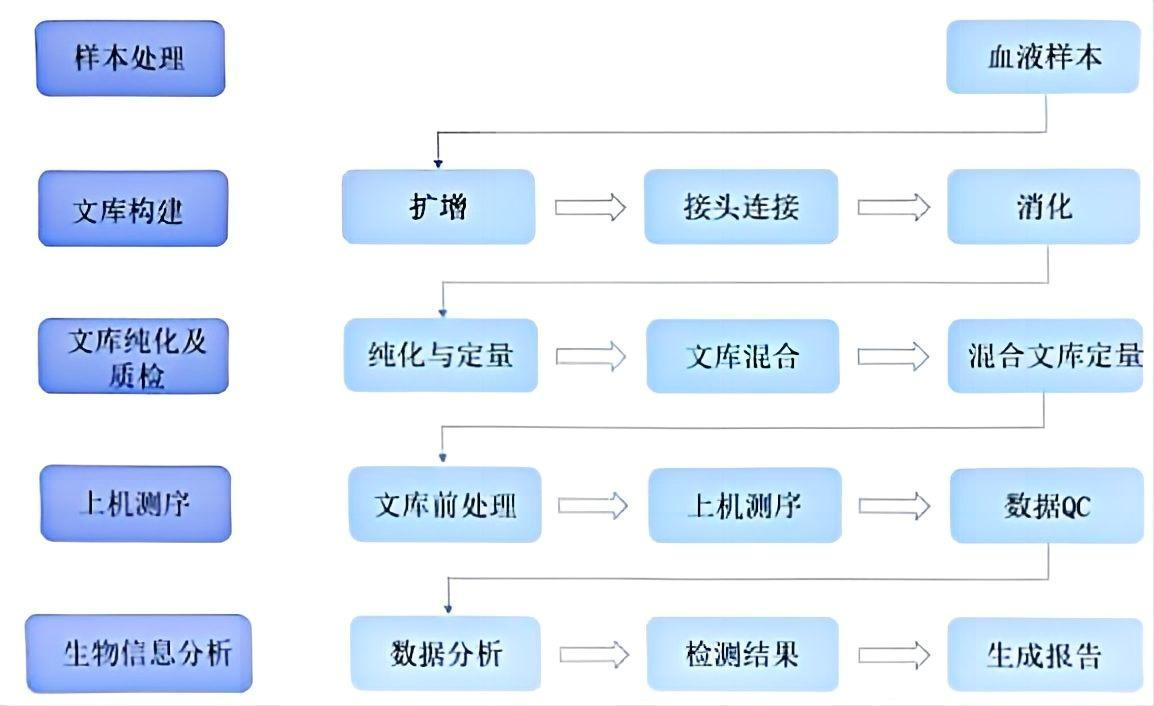
图1.技术原理图
本试剂盒是基于第三代测序技术平台,利用单分子实时DNA测序技术(Single Molecule Real-Time(SMRT))。针对人全血样本,通过在各突变位点附近设计引物,直接从全血样本中对目标DNA区域开展长片段扩增,在目标DNA长片段扩增产物两端连接接头,使用消化酶去除非环状片段,最终获得哑铃状文库。试剂盒配套使用基因测序仪Sequel®IICNDx,构建好的哑铃状文库结合测序引物与酶,在 SMRTCell的纳米小孔(ZMW)中开展单分子测序。测序后的基因序列比较到参考基因序列上,通过生物信息软件研究,可以准确识别携带基因突变的DNA 序列,获得相关基因突变信息。
【主要组成成分】
建库试剂的主要组成成分如下:
试剂名称 | 组分名称 | 主要成分 | 规格及数量 |
α与β 地中 海贫血基因 检测试剂盒 (单分子测 序法) | 扩增酶 | DNA聚合酶 | 48μL/管×1管 |
扩增液 | dNTP; Mg2+ | 1.2 mL/管×1管 | |
引物A | 引物混合物 | 30μL/管×1管 | |
引物B | 引物混合物 | 30μL/管×1管 | |
引物C | 引物混合物 | 30μL/管×1管 | |
引物D | 引物混合物 | 30μL/管×1管 | |
引物E | 引物混合物 | 30μL/管×1管 |
引物F | 引物混合物 | 30μL/管×1管 | |
引物G | 引物混合物 | 30μL/管×1管 | |
引物H | 引物混合物 | 30μL/管×1管 | |
连接酶 | DNA ligase | 88μL/管×1管 | |
连接液 | DNA ligase buffer | 132μL/管×1管 | |
消化酶1 | 外切酶 | 120μL/管×1管 | |
消化酶2 | 外切酶 | 120μL/管×1管 | |
阴性质控品 | 人细胞系基因组DNA, 20 ng/µL,基因型为αα/αα;N | 10μL/管×1管 | |
阳性质控品1 | 人细胞系基因组DNA, 20 ng/µL,基因型为-α3.7/αα; IVS-II- 654(C>T)杂 合,CD71/72(+A )杂合 | 10μL/管×1管 | |
阳性质控品2 | 人细胞系基因组DNA, 20 ng/µL,基因 型为αCSα/αα; N | 10μL/管×1管 | |
接头(TA01~TA48) | DNA溶液 | 6μL/管×48管 |
注意:1、建库试剂不同批次间的试剂盒组分不可以相互替换使用。
2、8 管引物,每管能配制12 个反应,搭配不同的接头使用,共96个反应。
3、每管接头可使用2次,不同引物可搭配使用一致接头。
4、试剂盒规格为 96 人份,8 个引物与 48 个接头最多可组成8*48=384 种组合,建议使用组合如下:
引物与接头组合 | 试剂盒1 (96 rxn) | 试剂盒2 (96 rxn) | 试剂盒3 (96 rxn) | 试剂盒4 (96 rxn) |
引物A | 01-12 | 13-24 | 25-36 | 37-48 |
引物B | 13-24 | 25-36 | 37-48 | 01-12 |
引物C | 25-36 | 37-48 | 01-12 | 13-24 |
引物D | 37-48 | 01-12 | 13-24 | 25-36 |
引物E | 01-12 | 13-24 | 25-36 | 37-48 |
引物F | 13-24 | 25-36 | 37-48 | 01-12 |
引物G | 25-36 | 37-48 | 01-12 | 13-24 |
引物H | 37-48 | 01-12 | 13-24 | 25-36 |
5、阴性质控品、阳性质控品1、阳性质控品2、空白对照NTC至少会占用4 个引物与接头组合。
测序试剂的主要组成成分如下:
试剂名称 | 组分名称 | 英文名称 | 主要成分 | 规格及数量 | |
测序反应通用试剂盒(测序法) | 测序试剂A | 测序引物v4 | Sequencing Primer v4 | 引物 DNA | 3μL/管 ×1管 |
引物缓冲液v2 | 10X Primer Buffer v2 | Tris-Buffer | 70μL/管×1管 | ||
DNA 文 库对照品 1.0 | Sequel®II DNA Internal Control Complex 1.0 | 2kb DNA-聚 合酶复 合物 | 24μL/管×1管 | ||
DNA聚合酶 2.1 | Sequel®II DNA polymerase 2.1 | 聚合酶 | 40μL/管×1管 | ||
稀释缓冲液 | Sequel® Complex Dilution Buffer | Tris-Buffer | 1600μL/管×1管 | ||
DTT | DTT | 二硫苏糖醇 | 450μL/管×1管 | ||
结合缓冲液 | Sequel® Binding Buffer | Tris-Buffer | 1500μL/管×1管 | ||
dNTP | Sequel® dNTP | dNTPs | 200μL/管×1管 | ||
添加剂 | Sequel® Additive | 添加剂 | 700μL/管×1管 | ||
测序试剂B | 洗脱液 | Elution Buffer | Tris-Buffer | 70μL/管×1管 | |
磁珠 | AMPure® PB beads | 四氧化 三铁磁 性微球 (包被 羧基) | 440μL/管×1管 | ||
测 序 试 剂 C | 测序试剂C2.0 | Sequel®II Sequencing Plate 2.0 (1rxn) | 金属离子、 dNTP、 荧光物 质、 DTT、镁 | 1次反应 /盒×1 盒 | |
测序试剂D | 测序芯片 | SMRT® Cell 8M(1- Cell Tray) | / | 1芯片/盒×1盒 | |
矿物油 | Sequel® SMRT® Cell Oil | / | 1600μL/管×1管 | ||
管塞 | TubeSepta | / | 2个/袋 ×1袋 | ||
一次性吸头v2 | Sequel® Pipet Tips v2 | / | 96个/盒×3盒 | ||
铝箔 | Sequel® Sample Plate Foil | / | 2片/袋 ×1袋 | ||
96孔样品板 | Sample Plate | / | 1个/袋 ×2袋 | ||
96孔混匀板 | Sequel® Mixing Plate | / | 1个/袋 ×2袋 |
注:1. 测序试剂不同批号试剂盒的以上组分不能互换使用。
2. 管塞、一次性吸头 v2、铝箔、96 孔样品板与 96孔混匀板为试剂盒自带耗材。
自备试剂、耗材与仪器
不包括,但需要配套使用的耗材、试剂及仪器:
用途 | 试剂/仪器名称 | 货号 | 注册/备案证号 |
文库纯化 | 核酸纯化试剂(杭州贝瑞与康基因诊断技术有限公司生产) | R0048 | 浙杭械备20220777 |
文库定量 | QubitTMdsDNA HS Assay Kit(Thermo FisherScientific公司 生产) | Q32854 | / |
数据研究 | 地中海贫血基因检测数据研究软 件(完整版本号: | A0013 | 浙械注准20252211275 |
V3.0.0.20250908,杭州贝瑞与康基因诊断技术有限公司生产) | |||
其他仪器 | Qubit荧光计:Qubit2.0 及其以上版本(Thermo Fisher Scientific 公司生产) | Q32866或 Q33216或 Q33238 | / |
移液器、涡旋震荡仪、离心机、 磁力架、PCR 仪、96 孔板涡旋 仪、96 孔板热封机等 | / | / | |
空白对 照 (NTC ) | DNase/RNase-Free 去离子水 | / | / |
其他试剂 | 无水乙醇(研究纯) | / | / |
DNase/RNase-Free 去离子水 | / | / | |
其他耗材 | 无核酸酶PCR 管 | / | / |
无核酸酶吸头 | / | / |
【储存条件及有效期】
建库试剂:
-20℃±5 ℃密闭保存,有效期12个月。
有效期内反复冻融次数不超过 4次;-20℃±5℃运输,运输时间不超过142h。
测序试剂:
测序试剂A于-20 ℃±5 ℃保存,测序试剂B于2℃~8 ℃保存,测序试剂C 于-20℃±5℃保存,测序试剂D 于15 ℃~30℃保存;有效期6 个月。
效期内避免反复冻融;储存条件即为运输条件,运输时间不超过142h。
生产日期、使用期限见试剂盒标签。
【适用仪器】
基因测序仪:型号Sequel®IICNDx(医疗器械注册证号:,杭州贝瑞与康基因诊断技术有限公司生产)
【样本要求】
1. 检测样本类型:人外周静脉全血,所用抗凝剂为EDTA。
2. 样本采集及处理:
2.1样本采集:使用已批准的EDTA抗凝采血管收集人全血样本,应无显著溶血或凝血现象。
2.2样本处理:采集后轻柔颠倒混匀3次。
3. 样本运输:于2℃~8℃条件下运输不超过72小时。
4. 样本保存:于2℃~8℃保存并于14天内开展检测,-20℃±5℃条件下可保存2年,冷冻保存时反复冻融不超过5次。
【检验方法】
1.文库构建
试剂于-20℃±5℃保存,使用前将试剂取出于冰上解冻,并充分混匀。操作过程中各反应组分均需放置于冰上。实验需同时检测空白质控(NTC)、阴性质控品(NC)、阳性质控品1(PC1)、阳性质控品2(PC2)。
引物A/B/C/D/E/F/G/H 每个反应使用2 μL,引物变性考虑挥发损耗,建议每种引物多吸取2 个反应用量。引物使用前,按如下程序单独开展预变性处理(热盖温度105℃),PCR 程序结束立即取出,置于冰上。
引物预变性处理 | 温度 | 时间 |
引物A/B/C/D/E/F/G/H | 98℃ | 30min |
1.1扩增
1.1.1扩增MIX配制:考虑到试剂损耗,建议多配制 1个反应用量,按下表比例计算扩增酶、扩增液与引物(8管引物,每管能配制12个反应,共96个反应)的用量,并开展配制。若使用引物不同,则将其配成含有不同引物的扩增MIX,充分混匀,瞬时离心5秒,放置冰上待用。
组分 | 单个反应加入量(μL) |
扩增液 | 10.0 |
扩增酶 | 0.4 |
引物A 或/B/C.../H(其中之一) | 2.0 |
DNase/RNase-Free 去离子水 | 6.6 |
1.1.2准备0.2 mL 无核酸酶PCR管,按下表加样量,在每个PCR管中加入19μL 扩增MIX;再分别在每管中加入NTC /NC /PC1/PC2/样本,建议按照引物加接头序号标记PCR管。充分混匀,瞬时离心5秒钟,轻弹去除气泡,放置于冰盒中。
组分 | 单个反应加入量(μL) |
扩增MIX | 19.0 |
NTC /NC /PC1/PC2 /样本 | 1.0 |
反应终体积 | 20.0 |
1.1.3将步骤1.1.2中的PCR管放入预先设置好的PCR仪中,开始下列程序开展反应(热盖温度 105℃,反应体积20μL):
温度 | 时间 | 循环数 |
98℃ | 2 min | 1 |
98℃ | 10s | 32 |
63℃ | 15s | |
68℃ | 3 min | |
68℃ | 5 min | 1 |
4℃ | ∞ | / |
1.1.4程序结束后取出PCR管,离心扩增产物,取4μL 扩增产物上清液加入新的0.2mL无核酸酶PCR管内,置于冰上待用。
1.2接头连接
1.2.1按下表比例计算连接液、连接酶与 DNase/RNase-Free去离子水的用量,配成连接MIX。
组分 | 单个反应加入量(μL) |
连接液 | 1.2 |
连接酶 | 0.8 |
DNase/RNase-Free 去离子水 | 1.5 |
1.2.2将步骤1.1.4中PCR管瞬时离心5秒。分别加入2.5μL 接头(每管接头可使用2次,不同引物可搭配使用一致接头)于PCR管壁上,按照引物与接头顺序标记PCR管,瞬时离心5秒钟。再将3.5μL连接MIX分别加入PCR管中,见下表,瞬时离心5秒钟,然后快速混匀,瞬时离心5秒钟并轻弹去除气泡,再瞬时离心5秒钟,放置于冰盒中。
组分 | 单个反应加入量(μL) |
扩增产物上清液 | 4.0 |
接头 | 2.5 |
连接MIX | 3.5 |
反应终体积 | 10.0 |
1.2.3将步骤1.2.2中的PCR管放入预先设置好的PCR仪中,开始运行下列程序(热盖温度 75℃,反应体积10μL):
温度 | 时间 |
37℃ | 20 min |
25℃ | 15 min |
65℃ | 10 min |
4℃ | ∞ |
1.2.4程序结束后取出PCR管,置于冰上待用。
1.3消化反应
1.3.1按下表比例计算消化酶1与消化酶2的用量,配成消化酶MIX。
组分 | 单个反应加入量(μL) |
消化酶1 | 1.0 |
消化酶2 | 1.0 |
1.3.2充分混匀,瞬时离心5秒。在步骤1.2.4的PCR管中分别加入2 μL配制好的消化酶MIX,反应终体系见下表。扣上管盖,瞬时离心5秒钟,然后快速混匀,瞬时离心5秒钟并轻弹去除气泡,再瞬时离心5秒钟,放置于冰盒中。
组分 | 单个反应加入量(μL) |
连接产物 | 10.0 |
消化MIX | 2.0 |
反应终体积 | 12.0 |
1.3.3将步骤1.3.2中的PCR管放入预先设置好的PCR仪中,开始运行下列程序(热盖温度 45℃,反应体积12μL):
温度 | 时间 |
37℃ | 60 min |
4℃ | ∞ |
1.3.4程序结束后取出 PCR 管,置于冰上,需立即开展下一步的文库纯化反应。
2.文库纯化
以上反应完成后,应立即使用配套的DNA纯化试剂盒纯化处理,按照以下步骤开展操作。
2.1 第一次纯化
2.1.1 在消化产物PCR 管中加入7.2 μL 磁珠,中速涡旋混匀,瞬时离心5s,室温孵育10 min;
2.1.2将上述PCR管瞬时离心5s后放置于磁力架上,吸附至清澈即可;
2.1.3沿吸附磁珠的对侧管壁加入200μL70%乙醇,加入后立即用移液器吸取上清丢弃;再次加入200 μL70%乙醇,加入后立即用移液器吸取上清丢弃,尽可能减少磁珠在空气中暴露的时间;
2.1.4 将PCR 管从磁力架上取下,瞬时离心5 秒,再次将PCR 管放置到磁力架上,用10μL 移液器吸弃所有废液;
2.1.5 立即加入22 μL 洗脱液后振荡悬浮磁珠,室温孵育10min;
2.1.6 将上述PCR 管瞬时离心5 s,然后放置于磁力架上,吸附至清澈即可,吸取20μL 上清转移至新的0.2mLPCR 管中,随后开展第二次纯化。
2.2 第二次纯化
2.2.1在第一次纯化产物中加入 12μL磁珠,中速涡旋混匀,瞬时离心5s,室温孵育10min;
2.2.2将上述PCR管瞬时离心5s后放置于磁力架上,吸附至清澈即可;
2.2.3沿吸附磁珠的对侧管壁加入200μL70%乙醇,加入后立即用移液器吸取上清丢弃;再次加入 200μL70%乙醇,加入后立即用移液器吸取;
2.2.4 将PCR 管从磁力架上取下,瞬时离心5 秒,再次将PCR 管放置到磁力架上,用10μL 移液器吸弃所有废液;
2.2.5 待磁珠不反光(约20s)立即加入8 μL 洗脱液后振荡悬浮磁珠,磁珠不能过于干燥,室温孵育10min;
2.2.6 将上述PCR 管瞬时离心5 s,然后放置于磁力架上,吸附至清澈即可,吸取7.5μL上清转移至新的0.2mLPCR管中。纯化后的文库于-20℃±5℃保存。
2.3 注意事项
2.3.1 70%乙醇建议现配现用,避免污染。
2.3.2 磁珠在使用前应充分旋涡震荡混匀。
2.3.3 第一次文库纯化洗脱时,尽可能快的加入洗脱液,避免磁珠过于干燥,影响出库浓度。
2.3.4 文库纯化过程中所有室温孵育步骤时间为10min,期间振荡混匀2次,确保DNA 与磁珠充分结合。
2.3.5 加入70%乙醇后,立即直接吸出,无需晃动磁力架,可提高利用率纯化时间,提高纯化回收效率。
2.3.6 纯化过程中的室温孵育温度为10℃~30℃。
3.文库质检
3.1纯化所得文库使用 Qubit 荧光计检测,应满足以下条件方可开展下一步的上机测序:
3.1.1单个文库浓度≥3ng/μL;NTC文库浓度≤1ng/μL(无需上机测序)。
3.1.2按照等质量混合后的混合文库浓度≥3ng/μL。
3.2如不能立即上机测序,可将纯化后文库置于-20℃±5℃条件下保存,须在90天内上机测序,期间反复冻融不超过3次。
4.上机测序
4.1 操作前准备
4.1.1除聚合酶与文库对照品必须现取现用外,所有于-20℃±5℃保存的试剂使用前于 2℃~8℃或冰上充分解冻,避免反复冻融。
4.1.2准备冰盒,除纯化步骤需在室温下开展外,所有反应组分的使用与配制过程均需在冰上开展。
4.1.3准备无核酸酶吸头开展移液操作。
4.1.4准备宽口吸头,所有含 DNA 样本、DNA 聚合酶 2.1或DNA文库对照品 1.0 的试剂或反应体系均使用宽口吸头缓慢吹吸 10~20次开展混匀(其余试剂或反应体系可涡旋混匀)。
4.1.5磁珠与缓冲液试剂使用前需混匀。
4.2 样品信息设置。
4.2.1打开基因测序仪的软件组件 SMRT®LinkBerryGenomics 服务器软件(以下简称“软件”),点击“Sample Setup”进入设置界面。
4.2.2点击“New Calculation”,在页面中输入相应信息。
4.2.2.1SampleName: 输入样本名称。
4.2.2.2 Available Volume& Concentration& Insert Size: 输入样本的有效体积、浓度与插入片段大小。
4.2.2.3SequencingPrimer&BindingKit: 分别选择“SequencingPrimer v4”与“Sequel® IIBindingKit2.1”。
4.2.2.4SequencingMode: 默认模式。
4.2.2.5Internal Control: 选择“Sequel® IIDNAInternal Control1.0”。
4.2.2.6Use Cleanup Step & Cleanup Anticipated Yield:选择“YES”开展纯化;设置纯化回收率为“50%”。
4.2.2.7Specify Concentration onPlate:文库最终上机测序时浓度建议在180~220pM。
4.2.2.8Cells toBind: 输入“1”。
4.2.2.9PrepareEntireSample: 选择是否将所有样本体积都用于后续流程。无特殊情况,不对软件默认选项开展更改。
4.2.2.10Advanced Options:高级设置,不建议更改。
4.2.3设置完成后,软件输出样本信息表,并指导步骤 4.3~4.6的开展。
4.3引物退火
4.3.1引物预处理
4.3.1.1按下表设置 PCR反应程序,热盖温度为 105℃,反应体积为30μL,运行并暂停:
反应温度 | 反应时间 |
80℃ | 2min |
4℃ | Hold |
4.3.1.2按下表加样。
组分 | 加样量(μL) |
测序引物v4 | 1 |
洗脱液 | 29 |
总体积 | 30 |
4.3.1.3混匀并瞬时离心,放入暂停的 PCR 仪中,运行 4.3.1.1程序。反应结束后转移到冰上立即使用或保存在-20℃±5℃,1 个月内使用。
4.3.2退火
4.3.2.1按下表设置 PCR 反应程序,无热盖,反应体积为100μL,运行并暂停:
反应温度 | 反应时间 |
20℃ | 60min |
4℃ | Hold |
4.3.2.2按照软件(AnnealingPrimer)给定的体积指导下表加样。
组分 | 加样量(μL) |
水 | 补水至总体积 |
引物缓冲液v2 | 总体积×0.2 |
样品 | 处理芯片数量×上机浓度÷文库摩尔浓度×0.253 |
预处理测序引物 v4 | 总体积×0.12 |
总体积 | 样品体积×文库摩尔浓度 |
4.3.2.3混匀并瞬时离心,放入暂停的 PCR 仪中,运行 4.3.2.1程序。反应结束后转移到冰上立即使用或保存在-20℃±5℃,1 个月内使用。
4.4聚合酶连接
4.4.1聚合酶稀释
4.4.1.1使用结合缓冲液将DNA聚合酶2.1开展10倍稀释。
4.4.1.2混匀并瞬时离心,稀释后的聚合酶立即使用。如有残余,则需遗弃。
4.4.2连接
4.4.2.1按下表设置 PCR 反应程序,无热盖,反应体积为100μL,运行并暂停:
反应温度 | 反应时间 |
30℃ | 60min |
4℃ | Hold |
4.4.2.2按照软件(Binding)给定的体积指导下表加样。
组分 | 加样量(μL) |
结合缓冲液 | 退火后样品体积×0.22 |
水 | 补水至总体积 |
DTT | 退火后样品体积×0.2 |
dNTP | 退火后样品体积×0.2 |
退火后样品 | 上一步骤中的总体积÷1.1 |
稀释后 DNA 聚合酶 2.1 | 退火后样品体积×0.2 |
总体积 | MAX(退火后样品体积÷(1-结 合体系系数),退火后样品体积 ×退火体系样品终浓度÷结合体 系样品浓度) |
4.4.2.3混匀并瞬时离心,放入暂停的 PCR 仪中,运行 4.4.2.1程序。反应结束后转移到冰上立即使用或保存在 2℃~8℃,7 天内使用。
4.5纯化
4.5.1纯化前,室温平衡磁珠与稀释缓冲液 30min。
4.5.2按照软件(AMPure®PBPurification of Polymerase BoundSMRTbell®Complexes 步骤 2)给定的体积指导下表加样。
组分 | 加样量(μL) |
聚合酶-模板复合物 | 上一步骤中的总体积 |
稀释缓冲液 | 总体积×0.7 |
总体积 | 上一步骤中的总体积÷0.3 |
4.5.3混匀并瞬时离心。
4.5.4使用Qubit荧光计及其配套试剂测定其浓度,并在软件(AMPure®PBPurificationofPolymeraseBoundSMRTbell® Complexes 步骤 3)中填写稀释后的聚合酶-模板复合物的体积与浓度。
4.5.5在稀释后的聚合酶- 模板复合物中加入软件(AMPure® PBPurification of Polymerase BoundSMRTbell®Complexes 步骤 4)给定体积
的磁珠(上一步骤中的总体积×1.2),混匀。室温静置 5min。注:严格控制在 5min,否则会影响纯化回收率。
4.5.6将样品放置于磁力架上,直到磁珠聚集到试管的一侧,溶液变得澄清,吸弃上清。
注:不要用乙醇清洗收集的磁珠。
4.5.7将样品从磁力架上取下,立即加入 105-120μL稀释缓冲液,混匀重新悬浮磁珠。
4.5.8将样品在室温下静置 15min,以洗脱聚合酶-模板复合物。
4.5.9将试管放置于磁力架上,至溶液澄清。
4.5.10将洗脱液转移至新的离心管中,转移到冰上待用或保存在 2℃~8℃,7天内使用。
4.5.11使用Qubit荧光计及其配套试剂测定其浓度,并在软件(AMPure®PBPurificationofPolymeraseBoundSMRTbell®Complexes步骤 11 中填写纯化后的聚合酶-模板复合物的体积与浓度。软件自动生成纯化后复合物的摩尔浓度与纯化回收率。
4.6 上机前文库稀释
4.6.1DNA 文库对照品1.0稀释
4.6.1.1按下表加样开展百倍稀释,混匀并瞬时离心。
组分 | 加样量(μL) |
稀释的缓冲液 | 99 |
DNA 文库对照品1.0 | 1 |
总体积 | 100 |
4.6.1.2按下表加样,对上一步完成的百倍稀释文库对照品开展万倍稀释,混匀并瞬时离心。
组分 | 加样量(μL) |
稀释的缓冲液 | 99 |
百倍稀释 DNA 文库对照品 1.0 | 1 |
总体积 | 100 |
4.6.2上机前文库最终稀释
4.6.2.1按照软件(Final Loading Dilution)给定的体积指导下表加样。
组分 | 加样量(μL) |
稀释缓冲液 | 98.5-纯化后的聚合酶-模板复合 物体积 |
纯化后的聚合酶-模板复合物 | 上机浓度÷纯化后复合物摩尔 浓度×115 |
万倍稀释 DNA 文库对照品 1.0 | 3.8 |
DTT | 11.5 |
添加剂 | 1.2 |
总体积 | 115 |
注:可在离心管中开展加样,也可以直接在 96 孔样品板中开展加样。
4.6.2.2瞬时离心,转移到冰上立即使用或保存在 2℃~8℃, 24h 内使用。
4.7准备样品板
4.7.1将 115 μL 最终稀释的文库全部转移到 96孔样品板上,并在190℃下用铝箔将板密封 2.5s。
注:不同型号热封机使用时,热封温度与时间存在差异,需自行测试;若步骤 4.6.2 直接在 96 孔样品板中开展,则直接热封。
4.7.2将样品板150rcf离心 1min。
4.7.3将样品板放置于冰上,直至装载到仪器上。
4.8准备试剂
4.8.1在 5s 内将矿物油管的盖子旋下,并更换为管塞。
4.8.2准备测序试剂 C 2.0。
4.8.2.1将测序试剂 C2.0 包装撕开排出内部气体,用防水胶带将开口重新密封。
4.8.2.2将测序试剂 C2.0 在室温(~22℃)下避光水浴 30~60min。解冻过程中,可将测序试剂 C2.0从水浴中取出,倒置、轻敲并通过了解板,看是否有任何残留的冷冻或沉淀物。重复以上操作 5 次以确保通过了解无
误,若板内试剂未完全融化,则将包装袋重新密封后继续水浴解冻。
4.8.2.3解冻后,将测序试剂 C2.01000rpm 涡旋混匀 1min。
注:具体使用参数可自行测试调整,但振荡强度不能超过 1200 rpm,振荡时间不能超过 1min。
4.8.2.4将测序试剂 C2.0 150rcf 离心 1min,以确保试剂位于板底部。
4.8.2.5装载到仪器前,擦去测序试剂 C2.0 上所有水分或污染物。
4.9 装载试剂、混匀板与样品板
4.9.1点击 Sequel® IICNDx 基因测序仪屏幕底部的“LOCKED”按钮,待其显示为“UNLOCKED”后,打开仪器门。
4.9.2将测序试剂 C2.0(不要将铝箔从测序试剂C2.0 上取下)放入标有“REAGENT”的试剂槽中。可选择“REAGENT1”或者“REAGENT2”装载,装载前要是试剂槽上积聚冷凝水,请先用纸巾吸干水分。要是在运行期间不使用第二个试剂板冷块,不要将其留空,请在此位置放置一个密封的空板,用于隔离冷块,可重复使用。
注:试剂板上有 NFC 标签,用于提示效期与跟踪库存。
4.9.3将矿物油放入位于试剂槽左侧的插槽中。插槽上序号需要与试剂槽上序号对应,其中“1”对应“REAGENT1”、“3”对应“REAGENT2”。确保管与插槽中的红线对齐。通过向下推试剂管,以确保试剂管放入正确位置。
注:试剂管有 NFC 标签,用于提示效期与跟踪库存。
4.9.4将 96 孔样品板放入标有“SAMPLE”的样品槽中。装载前要是样品槽上积聚冷凝水,请先用纸巾吸干水分。
注:装载测序试剂 C2.0、96 孔样品板时应紧贴并与试剂槽或样品槽平齐。要是板在放置时有碰撞,取出板重新离心,以确保所有试剂或样品都在孔底部。
4.9.5将空的未密封的 96 孔混匀板放入标有“MIXING”的槽中。
4.10装载测序芯片与吸头
4.10.1将测序芯片放入标有“CELL”的芯片槽中。芯片托盘轻轻滑入并卡入到位。可选择“CELL1”或者“CELL 2”装载。
注:托盘带有 NFC 标签,用于提示效期与跟踪库存。
4.10.2取下吸头盒(一次性吸头 v2)的盖子,将 3 盒吸头盒依次放入标有“TIPBOX”的槽中。确保吸头盒摆放正确并与工作台齐平。
注:该软件会记住使用吸头的最后位置,因此不要卸下或移动吸头盒。然而,要是关闭设备电源并重新启动,则最后一个已知的吸头位置将丢失。该单元应重新装满 3 个完整的吸头盒。请在开始新运行之前,将所有空的吸头盒替换为满的吸头盒。
4.11测序运行设置
4.11.1打开软件,点击“RunDesign”进入设置界面。
4.11.2点击“Create New Design”,在页面中输入相应信息,详细操作步骤参见《基因测序仪(Sequel® II CNDx)使用说明书》。
4.11.2.1BindingKit: 选择“Sequel® IIBindingKit 2.1”
4.11.2.2Sequencing Kit: 选择“Sequel®II Sequencing Plate 2.0(1rxn)”
4.11.2.3DNAControlComplex: 选择“Sequel® II DNAInternalControl1.0”。
4.11.2.4SequencingMode: 选择CCSREADS。
4.11.2.5Insert Size:2535bp。
4.11.2.6Movie Timeper SMRT Cell:15h。
5.数据研究
使用地中海贫血基因检测数据研究软件,按照软件说明书开展操作,具体数据研究方法:
5.1.一致性序列研究(Circular ConsensusSequencing,简称CCS)
CCS 模式数据处理过程包括去除接头序列、初始过滤、生成共识草图序列、比对、划窗口、校正、拼接等过程。
5.2 样本拆分
通过识别测序数据两端的barcode 序列与引物标签序列,开展样本拆分。
5.3 序列比对
将各样本拆分后获得的测序数据序列比对至人类参考基因组(NCBIGRCh38),再将包括成对引物的测序数据序列比对到目标基因区域,筛选得到目标序列(包括5 种HBA 序列:SEA_reads、4.2_reads、3.7_reads、
THAI_reads、WT_reads,统称为HBA_reads;以及1种HBB_reads)。
5.4数据质控
测序数据质控标准:单个文库数据产出HBA reads≥1000;HBBreads≥100。
5.5数据研究5.5.1α缺失
各缺失突变类型的检测值计算公式如下:SEA_ratio=SEA_reads/HBA_reads
4.2_ratio=4.2_reads/HBA_reads
3.7_ratio=3.7_reads/HBA_reads
THAI_ratio=THAI_reads/HBA_reads
WT_ratio=WT_reads/HBA_reads5.5.2点突变
按照各位点测到的所有序列数depth与突变序列数alt_depth,计算点突变比例检测值Mutation ratio,公式如下:
Mutation ratio=alt_depth/depth
【阳性判断值】
1. α缺失型阳性判断值
1.1α缺失型--SEA、-α3.7、-α4.2 与--THAI四者之一判断值≥5%,其他三者<5%,同时WT(野生型或非缺失)判断值≥5%,判定为对应α缺失型杂合突变。
1.2α缺失型--SEA、-α3.7、-α4.2 与--THAI四者之一判断值≥5%,其他三者<5%,同时WT判断值<5%,判定为对应的α缺失型纯合突变。
1.3α缺失型--SEA、-α3.7、-α4.2与--THAI 四者之二判断值≥5%,四者剩余的两个判断值<5%,同时WT判断值<5%,判定为对应四者之二的α缺失型双杂合突变。
1.4α缺失型--SEA、-α3.7、-α4.2与--THAI 四者同时判断值<5%,同时WT判断值≥5%,判定为αα/αα,未检出α缺失型。
判断值下文以SEA_ratio、4.2_ratio、3.7_ratio、THAI__ratio, WT_ratio(HBA 野生型)表示,具体判定规则参见下表(下表为常见的基因型):
SEA_ratio | 4.2_ratio | 3.7_ratio | THAI_ ratio | WT_ ratio | 检测结果 |
≥5% | <5% | <5% | <5% | ≥5% | --SEA/αα |
<5% | ≥5% | <5% | <5% | ≥5% | -α4.2/αα |
<5% | <5% | ≥5% | <5% | ≥5% | -α3.7/αα |
<5% | <5% | <5% | ≥5% | ≥5% | --THAI/αα |
≥5% | <5% | ≥5% | <5% | <5% | --SEA/-α3.7 |
≥5% | ≥5% | <5% | <5% | <5% | --SEA/-α4.2 |
<5% | ≥5% | ≥5% | <5% | <5% | -α3.7/-α4.2 |
<5% | ≥5% | <5% | <5% | <5% | -α4.2/-α 4.2 |
<5% | <5% | ≥5% | <5% | <5% | -α3.7/-α3.7 |
<5% | <5% | <5% | <5% | ≥5% | αα/αα |
2. α与β点突变阳性判断值
2.1Mutationratio≥20%,且≤80%,判定为对应杂合点突变;
2.2Mutationratio>80%,判定为对应纯合点突变;
2.3Mutation ratio<20%时,判定为N,表示未检出检测范围内的突变。
【检验结果的解释】
1.阴阳性质控结果:阴性质控品检测结果为未检出突变,基因型为αα/αα;N;阳性质控品1检测结果为阳性,基因型为-α3.7/αα;IVS-II-654(C>T)杂合,CD71/72(+A)杂合;阳性质控品 2 检测结果为阳性,基因型为αCSα/αα;N。
2.结果判断:阴阳性质控结果正确是实验结果有效性的前提,否则实验结果不可信。
3.结果研究:α 缺失型阳性报出对应基因型(--SEA/αα、-α3.7/αα、-α4.2/αα、--THAI/αα、--SEA/-α3.7、--SEA/-α4.2、-α3.7/-α 4.2、-α3.7/-α 3.7、-α 4.2/-α4.2等),未检出缺失时报出基因型αα/αα,表示未检出α缺失;α点突变阳性报出αWSα(HbWestmead)、αCSα(HbCS)、αQSα(HbQS)对应的杂合或纯合;
β点突变阳性报出对应位点突变杂合或纯合。α与β点突变未检出突变信息时报“N”。
4. 无应答检测情形:软件界面检测结果为“-”, 表示样本检测出3 种及以上缺失的组合,或数据质控不合格,建议从全血开始复测。
【检验方法的局限性】
1. 本产品仅适用于基因测序仪 Sequel® II CNDx(杭州贝瑞与康基因诊断技术有限公司生产),不适用于其他品牌或型号的机型。
2. 本产品仅对预期用途中检测范围内的变异类型开展了研究性能验证,对于未包括在检测范围内的其他变异或未知变异,存在漏检风险。
3. 密切相关假阴性结果的概率研究:
3.1不可靠的样本采集、运送有可能结果假阴性结果。
3.2未经验证的其他干扰或PCR抑制因子等可能会结果假阴性结果。
3.3 试剂过期、未按软件以及说明书指导开展操作、样本受损或污染、测序系统故障等,可能会影响试验结果。
【产品性能指标】
1.建库试剂外观:试剂盒应清洁、标识清晰无破损、各组分标签无错误或脱落;各组分封存无漏液。试剂均为无色透明状液体,无肉眼可见的固体悬浮物或沉淀物。
测序试剂外观:试剂盒应清洁、标识清晰无破损、各组分标签无错误或脱落;各组分封存良好无漏液;耗材组分以及测序芯片无破损;测序试剂C包装袋无漏气。
2. 准确性:按照基于试剂盒检测范围内的地中海贫血核酸检测国家阳性参考品与/或企业阳性参考品开展检测,应检出对应的突变类型。参考品应涵盖试剂盒检测范围内的所有变异类型。
3. 特异性:按照基于地中海贫血核酸检测国家阴性参考品与试剂盒检测范围外的国家阳性参考品开展检测,或按照基于企业阴性参考品开展检测,结果均应为阴性。
4. 检测限:按照基于试剂盒检测范围内的地中海贫血核酸检测国家阳性参考品与/或企业检测限参考品开展检测,不高于3ng或1000拷贝的上样量条件下,应检出对应的突变类型。参考品应涵盖试剂盒检测范围内的所有变异类型。
5. 重复性:按照基于企业参考品开展重复检测,各参考品的结果均一致,且应检出对应的突变类型。
6.临床试验:本产品在临床试验机构一共完成1588例临床样本的检测,与已上市产品开展比较研究,阳性符合率、阴性符合率与总符合率均为100%,Kappa系数为1。
【注意事项】
1. 本试剂盒仅用于体外诊断。请在使用前仔细阅读此说明书,并确认按说明书要求已准备相应试剂、耗材与仪器。如出现与试剂盒描述纷歧致请立即停止使用。
2. 使用时注意:
2.1不要使用超过有效期的试剂。
2.2不要混用不同批号与试剂盒之间的其它试剂。
2.3按说明书的保存条件开展试剂保存。
2.4 使用前对试剂盒的外观开展通过了解,确保试剂盒外观整洁,标记清晰,无漏液,标签无破损或脱落方可使用。如有异常,请停止使用。
2.5收样人员要做好样本的核对工作,避免样本编号重复,并确认样本信息正确。
3. 操作时注意:
3.1 试剂盒使用环境应符合PCR 标准实验室要求。
3.2实验应由具备专业背景与技能的、熟悉操作流程的人员开展操作,需严格按照操作步骤开展实验,不得私自改动或简化,必要时需开展培训。
3.3 使用适用机型及配套软件版本,严格按照仪器标准操作规程操作及软件说明书操作,测序仪及研究软件需按照相应要求开展定期维护。
3.4 使用前将试剂盒及盒内所有组分应充分解冻。用过的冻存管必须仔细盖紧后保存。
3.5因为避免潜在组分污染,未使用完的试剂不应转移回原瓶。
3.6所有操作步骤中,NTC(水)、阴性质控品、阳性质控品1与阳性质控品2 在同一批操作中起初加样。
3.7因为磁珠溶液粘稠,移取操作时需缓慢以确保其全部打入离心管。
3.8 上机测序步骤中,所有反应体系配制后,请用宽口吸头缓慢吹吸10~20次的方式开展混匀操作;需要开展移液操作前,如试剂有挂壁现象,请使用迷你离心机短暂离心2~3s。
3.9 一致引物与接头组合编号的样本不得在同一芯片中测序。
3.10装载到仪器前,96 孔样品板必须热封。必须用试剂盒配套的铝箔开展密封,否则可能结果运行失败。另外, 因为热密封必然会损害样品板的某些结构,因此不建议重复使用样品板。装载到仪器前,96 孔混匀板无需热封。
3.11试剂盒所提供的试剂使用完毕,需及时盖紧管盖,按实验室生物废料(废液)处理。
3.12实验结束后应立即清洁工作台,并定期对工作台及各种实验用品开展消毒。
4.安全注意事项:
4.1 所有检测样本与质控品污染的材料(含废液)必须按照适用的规定经有效程序(高压灭菌或化学处理)灭活。本试剂盒内试剂废弃物及实验过程中的废弃物应按医疗废弃物开展处理,实验废弃的PCR反应管应按照实验室相关规定开展处理以防止污染。
4.2 操作过程应工作服、帽、鞋、手套等穿戴齐全,各区物品均为专用,不得交叉使用,避免污染。试剂可能刺激眼睛、皮肤与黏膜;一旦接触,应立即用大量清水冲洗并咨询医生。
4.3 本试剂盒内所配对照品经检测不具有传染性,但在使用时建议将其视为具有潜在传染性物质开展处理。
【标识的解释】
1. Cat:组分编号
2.Lot:生产批号
【参考文献】
[1] Weatherall DJ,Clegg JB. Inherited hemoglobin disorders:anincreasingglobal health problem[J]. Bulletin World Health Organ, 2001,(79): 704-712.
[2] 杨阳, 张杰. 中国南方地区地中海贫血研究进展[J]. 中国实验血液学杂志, 2017, 25(1):276-280.
[3] 徐湘民.地中海贫血预防控制操作指南[M].北京:人民军医出版社,2011.
[4] 林娜,黄海龙,王燕,等.泰国缺失型α 地中海贫血1的基因诊断与临床血液学表型研究[J].中国实验血液学杂志,2016,24(4):1116-1120.
[5] 陈萍,李树全,李敏清,等.泰国缺失型α 地中海贫血1的产前基因诊断.中华医学遗传学杂志,2007,24( 3):247-250.
[6]阙婷,张强,唐燕青,等. 广西地区泰国缺失型α-地中海贫血的调查研究[J].国际检验医学杂志,2013,34(13):1703-1706.
[7] XM Xu, YQ Zhou, GX Luo,etal.Theprevalenceandspectrumof αandβthalassaemiainGuangdongProvince:implicationsforthefuturehealthburden and population screening[J].J Clin Pathol, 2004, 57(5):517-522.
[8] Traeger-Synodinos J,Harteveld CL,OldJM,et al.EMQNBestPracticeGuidelinesformolecularandhaematologymethodsforcarrieridenticationandprenataldiagnosis ofthehaemoglobinopathies[J].EurJ Hum Genet,2015,23(4);426-437.DOI;10.1038/ejhg.2014.131.
[9] Brancaleoni V,DiPierroE ,Motta I, et al.Laboratory diagnosis ofthalassemia[J].Int J LabHematol,2016,38 (Suppl 1):32-40. DOI;10.:1111/ijlh.12527.
【基本信息】
注册人/生产企业/售后服务单位:杭州贝瑞与康基因诊断技术有限公司住所:浙江省杭州经济技术开发区白杨街道6号大街260号9幢,16幢一层、二层
电话:
网址:
E-maiL:
生产地址:杭州经济技术开发区白杨街道6号大街260号9幢,16幢一层、二层,18幢二层
生产许可证编号:
【医疗器械注册证编号/产品技术要求编号】
【说明书核准及修改日期】
核准日期:
修改日期:



 1181
1181

