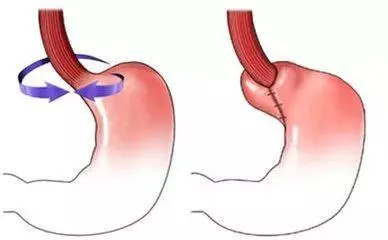
在医院泌尿科或男科门诊常被当作常规装备的这一器具,主要用于医生为患者实施包皮环切手术,其原理是借助内外环产生的机械压力使多余包皮组织逐渐坏死并脱落,相较于传统手术刀方式,具有出血较少且操作相对简便的特点,尽管它的结构并不复杂,仅由两个环组成,并且以非无菌状态提供,但鉴于其需要直接接触人体敏感部位,还要通过压迫方式实现组织坏死,因此国家药监局将其划定为第一类无源医疗器械开展管理,虽然只是备案而非注册,但相关流程却丝毫不能省略,接下来我会详细阐述如何一步步完成这个备案,确保分享的全是具有实操性的干货内容,不会掺杂半句虚言。

第一步 先整明白产品属性与备案门槛
按照《医疗器械分类目录》可知,包皮切除环弄清楚被归为第一类无源医疗器械,其分类编码一般是02 - 15 - 04或者02 - 15 - 05,而这一分类情况意味着该器械走的是备案程序而非注册审批,且整个备案周期短的话一个月左右,长的话可能达到三个月,与二类、三类器械相比,在时间与精力上都节省了不少;需要注意的是,备案申请应向设区的市级药品监督管理部门提交,既不是省局,也不是国家局,同时产品描述必须清晰地表明该器械由带有切口的外环与内环组成,若材料为医用高分子材料,则需注明具体类型,像PP或者PE等;另外,预期用途被严格限定在环切阴茎包皮方面,不能自作主张地添加如美容整形或者疾病治疗之类的功能,不然备案肯定会被拒绝,并且在这个阶段就需要开始准备产品技术要求,要弄清楚环的尺寸精度、弹性回复率、生物相容性等基本指标,虽然一类器械的要求相对简单,但该有的指标却一个都不能缺少。
第二步 准备备案材料这套基本功
备案材料作为整个过程的根本需准备全套技术文件,其中涵盖产品技术要求、风险研究报告、产品检验报告以及说明书标签样稿等,而针对包皮切除环这类一类无源器械,产品技术要求中需弄清楚规定环的尺寸公差、断裂强度、耐腐蚀性能等基本指标,风险研究报告则要对环断裂、组织嵌顿、压迫过度等潜在风险开展系统研究并给出相应控制措施,生物相容性评价需证明所有接触人体的材料不会引起毒性反应或刺激,尽管一类器械可做自检报告,但倘若企业自身检测能力不足,为稳妥起见建议委托有资质的检验所出具报告,同时所有材料需用A4纸清晰打印并按顺序装订成册,且每份材料均需盖上公司公章。
材料类型 | 根本内容 | 特别注意项 |
产品技术要求 | 环的尺寸精度、弹性回复率、断裂强度 | 指标必须量化可测 |
风险研究报告 | 研究环断裂、压迫过度、组织损伤等风险及控制措施 | 需包括异常情况处理预案 |
生物相容性评价 | 材料细胞毒性、皮肤刺激性测试 | 若材料与已上市产品不同需补试验 |
说明书标签 | 产品使用方法、禁忌症、注意事项 | 内容需符合相关法规要求 |
第三步 网上提交备案申请与后续跟进
当材料准备完成之后需通过药监局在线平台将备案申请提交上去,在全国范围内当前大部分地区都已实现网上办理这一便捷方式,无需再如过去那般携带纸质材料往返奔波,在提交申请之后监管部门会在5个工作日之内告知关于材料是否齐全的情况,若存在缺失情形则会一次性将需要补充的内容予以告知,从正式受理申请直至获取备案凭证,整个流程通常不会超过30个工作日,相较于二类、三类器械往往需要一年半载的审批时长要快速好多,在备案完成之后产品信息会在相关网站上开展公布,至此包皮切除环便具备了合法身份,能够开展正常的生产与销售活动。
第四步 备案后要留意这些事
即便已拿到备案凭证也并非意味着所有事项皆已妥善完结,当产品名称、型号或技术要求这类根本信息出现变动时需及时办理备案变更,而若企业生产地址的变更或法人代表的更换等信息产生变化仍然需要向监管部门开展报告,此外虽然一类医疗器械未对备案凭证设定弄清楚的有效期,但在相关法规标准出现重大变化的情形下可能需要依照要求重新开展备案,并且平时需做好产品质量的跟踪工作,在出现客户投诉或不良事件的情况下均应有记录可供查询。
当涉及到关于包皮切除环的备案事宜时,若您有此需求,或许可以考虑向类似飞速度CRO这种在行业内具备一定专业性且积累了相应咨询经验的CRO咨询机构开展咨询,从而以一种可能较为系统的方式去获取与该备案事项相关的详细信息,不过需要注意的是,整个咨询过程以及所获取信息的全面性与准确性可能会受到多种因素的影响,这些因素包括但不限于机构当前的业务范围、人员配备以及对相关政策法规的理解与掌握程度等。


 1322
1322

