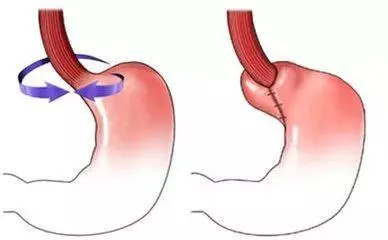
在骨科手术里当医生对韧带损伤开展处理之际,被当作精细“手工编织器”的这种一次性肌腱编织器,能够借助缝线将几股软组织移植物紧紧地捆在一块,以此来避免末端出现撕裂情况,不过可别小瞧这个物件,要是缝线强度稍微差上几分,移植物就存在从骨道之中滑脱的概率,而要是固定装置的材料不符合标准,就可能在手术现场出现断裂,因为这类产品直接参与到软组织固定当中,并且属于侵入性操作,因此国家药监局弄清楚地将其划分为第二类医疗器械来开展管理,整个注册流程如同给产品办理一张“合规身份证”,需要经历材料准备、检测验证、临床评价等诸多关卡,接下来我会对具体的操作方式开展详细阐述。

第一阶段 搞清楚产品属性与准备基础材料
需确认产品分类事宜,按照2023年第三次分类界定结果汇总里的第二条第六项,一次性肌腱编织器被划为第二类医疗器械,而这一划分就意味着需向省级药监局提交注册申请,该注册申请的整个周期一般是在12到18个月左右,在产品描述方面必须清晰写明其是由固定装置以及不可吸收缝线共同组成的,尤其要说明缝线的纵行线带按照基于的是超高分子量聚乙烯材料,缠绕缝线则是由聚对苯二甲酸乙二酯与超高分子量聚乙烯混合编织而成的,产品的预期用途被严格限定在骨科手术中体外辅助编织软组织移植物,以起到防止移植物末端撕裂的作用,同时还需说明产品是以无菌状态提供并且为一次性使用的,在这个阶段便要开始着手准备产品技术要求,要弄清楚缝线的拉伸强度、固定装置的锁紧力等根本指标。
第二阶段 技术文档编写与产品检测
作为注册申请根本的技术文件需全面覆盖产品安全有效性证据,对于肌腱编织器这类产品而言重点在于产品技术要求的准备,其中需详细规定如固定装置锁紧力、缝线断裂强度、材料生物相容性等根本性能指标,同时风险研究报告需对缝线断裂、固定装置失效、组织损伤等潜在风险开展系统研究并给出相应控制措施,而生物相容性评价则要证明所有接触人体部件例如缝线不会引起毒性反应或组织刺激,检测方面需将样品送至有资质的医疗器械检验所开展全性能注册检验以获取合格报告,在此过程中尤其需要注意的是缝线强度的检测需模拟实际使用场景来开展测试。
材料类型 | 根本内容 | 特别注意项 |
产品技术要求 | 缝线强度≥XXN、固定装置锁紧力≥XXN | 指标必须量化可测 |
风险研究报告 | 研究缝线断裂、固定失效等风险及控制措施 | 需包括异常情况处理预案 |
生物相容性评价 | 缝线接触组织的细胞毒性、刺激性强度测试 | 若材料有变化需补充试验 |
灭菌验证报告 | 确认无菌保证水平达标 | 需提供灭菌过程验证参数 |
第三阶段 临床评价工作
第二类医疗器械一般而言需通过开展临床评价以证明其安全有效性,而该临床评价主要存在可归结成两种可供选择的途径,其一是与已上市的同品种医疗器械开展比较,在研究二者之间的一致点与不同点的基础上,对产品的安全有效性展开论证,其二是在无法找到合适的同品种产品的情况下,或者当产品具有创新之处时,可能需要开展临床试验以获取临床数据,并且若选择同品种比较这一路径,就需要提供详细的比较表,以此来说明申报产品与比较产品在结构组成、性能指标以及适用范围等方面所存在的一致性与差异性,同时还需对这些差异不会对安全有效性产生影响这一点开展论证。
第四阶段 提交注册申请与审评互动
当材料处于齐全状态时便能够朝着省级药品监督管理部门的方向提交注册申请,在提交这一行为完成之后会经历形式审查的环节,该环节的审查内容聚焦于资料是否具备齐全性以及是否与格式要求相契合,而在受理程序完成之后则会踏入技术审评的阶段,在这个阶段当中审评老师会对所有的资料展开细致入微的审查工作,同时对产品的安全有效性开展专业的评估,并且在这一过程里存在发出补正通知的概率,该通知会要求补充相关资料或者对问题作出说明,在此情形下企业负有在规定时间范围内一次性将资料补全的义务,另外在技术审评通过之后还会做出对生产企业的质量管理体系实施现场核查的摆设。
第五阶段 体系核查与取证后管理
体系核查作为注册过程里相当根本的一个环节,在这一环节当中,检查人员会依照相关法规前往生产现场,对企业的设计开发环节、生产过程控制环节以及检验检测环节等开展检查工作,尤其是对于固定装置与缝线的生产过程控制这部分内容,会开展重点的检查,而在通过体系核查之后,就会进入行政审批环节,一旦审核通过,就会向企业发表医疗器械注册证,该注册证有着5年的有效期,企业需要在注册证到期之前的半年时间指出延续注册的申请。
当考虑开展一次性肌腱编织器的注册相关事宜时,或许可以将咨询像飞速度CRO这种在行业内具备一定专业性且积累了相应经验的CRO咨询机构、从中获取关于该注册事项的详细信息以及相关流程的介绍等作为一种可参考的途径,不过具体的咨询效果与所获取信息的全面性可能会受到多种因素的影响,包括但不限于咨询时所提供的具体需求描述是否清晰、机构本身对于该类注册业务的熟悉程度等。


 1322
1322

