
应用纳米材料的医疗器械产品基于纳米材料具有尺寸效应、高表面反应活性等独特性质,其毒理学行为与传统材料有差异,传统研究方法可能无法全面准确识别与评价其安全性与有效性。近年来迅速发展的体外评价方法,尤其是新兴技术方法已日益成为医疗器械的补充评价手段。本指导原则是对应用纳米材料医疗器械按照基于新兴技术方法评价的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容开展充分说明与细化。注册申请人还应依据具体产品的特性确定其中的相关内容是否适用,若不适用,需详细阐述理由及相应的科学依据。
本指导原则是对注册申请人与审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,要是有能满足相关法规要求的其它方法,也可以按照基于,然而需要提供详细的研究资料与验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规与标准体系以及当前认知水平下制定的,随着法规与标准的不断改进,以及科学技术的不断发展,本指导原则相关内容也将开展适时的调整。
一、适用范围
本指导原则适用于与人体直接或间接接触,由纳米材料组成或包括纳米材料的医疗器械的新兴技术方法研究。注册申请人应注意:目前新兴技术方法不能代替传统生物相容性试验与动物试验研究方法,仅作为补充研究方法。
不适用于:
- 应用纳米材料的体外诊断产品;
- 应用纳米材料的药品;
- 纳米技术赋能的医疗产品。
二、综述资料
注册申请人在对应用纳米材料的医疗器械产品开展安全性评价时,若生物相容性试验与动物试验研究方法不能完全评价纳米材料风险,可按照基于新兴技术方法作为补充。新兴技术方法(New Approach Methodologies,NAMs)即可通过避免使用完整动物开展测试而提供化学品危害与风险评估信息的任何技术、方法或其组合。适用于应用纳米材料的医疗器械的新兴技术方法可以包括:体外试验中对相关生物标志物的检测及非临床评估模型(如:人或动物来源的体外模型、仿生材料或组织、计算机模拟等)。
新兴技术方法需要在传统的毒理评价体系要求中使用,无法代替现有的生物相容性试验与动物试验研究方法,但鼓励注册申请人应用新兴技术方法对现有标准方法开展优化,或是对常规方法无法获取的数据开展补充,尤其是在机制探索、危害表征、毒性风险预测方面,从而为应用纳米材料的医疗器械产品的风险评估提供更充分的依据。
注册申请人应当在综述资料中阐述申请注册应用纳米材料的医疗器械产品的研发背景与目的,应综述该类产品国内外研究及临床使用现状,阐明按照基于新兴技术方法开展相关研究的原因,现有研究方法的局限性,以及新兴技术方法对于现有研究方法的补充作用。
三、研究资料
对于应用纳米材料的医疗器械,注册申请人按照基于新兴技术方法开展研究时,应在研究资料中体现如下要求:
(一)通用要求
注册申请人在按照基于新兴技术方法对应用纳米材料的医疗器械产品开展风险评估时应提供充足的理由,如选择标准化方法,应对方法开展验证以提供方法适用性证据;如选择非标准化方法或经过确认/验证的非活体研究、计算机模拟等方法,应提供完整的方法开发、方法确认、方法验证材料。鼓励按照基于新兴技术方法作为常规试验方法的补充。
在按照基于体外评价/计算机模拟研究/分子模拟等新兴技术方法对应用纳米材料的医疗器械开展评价时,注册申请人应充分考虑方法的局限性与适用性,尤其是模型与真实人体健康组织与病变部位的差别对于结果解释造成的可能影响。
(二)数据提交要求
注册申请人在使用体外评价方法/计算机模拟评价应用纳米材料的医疗器械安全性与有效性时,需提交以下材料:
1.方法描述报告
方法背景描述:详细说明方法的原理、设计及操作方式,包括示意图、工程图纸、标签与使用说明。弄清楚方法类型(如非临床评估模型、生物标志物测试),说明方法为标准化方法还是新开发方法,若方法基于成熟标准,可引用以简化验证。
方法应用范围描述:测量目标(如:预测设备耐久性、评估生物标志物水平)。适用的开发阶段(如:设计评估、动物试验、临床试验、上市后研究)。限制条件:适用人群、参数范围、环境约束(如仅限特定设备类型或特定疾病患者群体)。
方法性能标准:定义客观的性能指标(如准确度、检测限、重复性)及对应的接受标准。示例:计算模型的数值收敛性、生物标志物检测的精确度(如±5%误差范围内)。
2.方法学验证报告
包括方法校准数据、敏感性与特异性研究、不确定度量化等结果。注册申请人应按照具体方法类型选择相适应的验证参数,如计算机模型提交代码验证、量化不确定度、与台架/动物实验数据的比较验证。生物标志物测试提交研究有效性数据(精确度、敏感性与特异性、检测限等)、临床相关性数据以证明生物标志物与临床结局的关联(如通过临床试验数据或文献)。
体外评价方法与标准方法比较数据推荐以表格形式体现出。遵循ASME V&V 40标准对方法开展风险分级评估;
数据提交模板示例:
测试项目 | 体外评价方法结果 | 标准方法结果 | 偏差研究 |
纳米颗粒释放量 | 2.1 μg/mL | 2.3 μg/mL | +9.5% |
注:本案例仅为提供体外评价方法与标准方法比较研究之用,数据无实际意义。
3.提供模型可信度证据
如引用已发表的验证研究(需提供全文及摘要)及独立实验室或多中心验证报告(如适用)。
4.争议解决策略:若体外与体内数据冲突,需提交专家评议记录或多方法交叉验证报告。
(三)计算机模拟研究要求
1.计算机模拟方法与应用
注册申请人如按照基于计算机模拟工具评价应用纳米材料的医疗器械时应避免依赖单一模型,建议结合多个相关模型及相关证据(如体外测试、毒理学数据)以提高评估的可靠性。必须基于高质量数据/数据库、形成或选择合适的模型,所使用的模型必须经过严格验证与专家评估以确保其适用性。计算机模拟工具可初步了解产品毒性特征与潜在毒性风险,其结果既作为常规毒理学试验数据的重要补充,也作为识别毒理学危害,增加毒理学评估终点或深入机制研究的依据之一。
用于医疗器械的计算建模可作为医疗器械整个生命周期中决策支持,包括设计阶段早期用于支持临床前评估与上市后不良事件的原因研究与改进设计。应用该工具应提交计算建模与模拟的可信度证据,包括模型的验证、确认、不确定度的量化、适用性与充分性研究等研究资料。该工具暂不适用于统计或数据驱动模型,如机器学习或人工智能。
2.模型的形成与验证流程
2.1 模型的形成
计算机模型形成应包括阶段一:启动阶段初始信息收集与风险评估;阶段二:数据收集目标及可信度目标的确立;阶段三:按照阶段一及阶段二信息开展前瞻性评估;阶段四:执行模型验证,汇总并研究验证数据;阶段五:基于前述证据执行后验性评估,见图1 应用纳米材料医疗器械计算机模型形成流程图。
2.2 模型验证的要求
2.2.1模型校准:基于高质量实验数据调整参数;
2.2.2实验比较:与体外/体内试验结果开展一致性研究(误差范围≤15%);
注:此处误差范围仅为示例,具体产品的误差范围应按照应用纳米材料的医疗器械适用范围、特性、使用风险等具体因素,按照以临床价值为导向的医疗器械设计开发原则来确定。
2.2.3敏感性研究:识别根本输入参数对输出的影响。
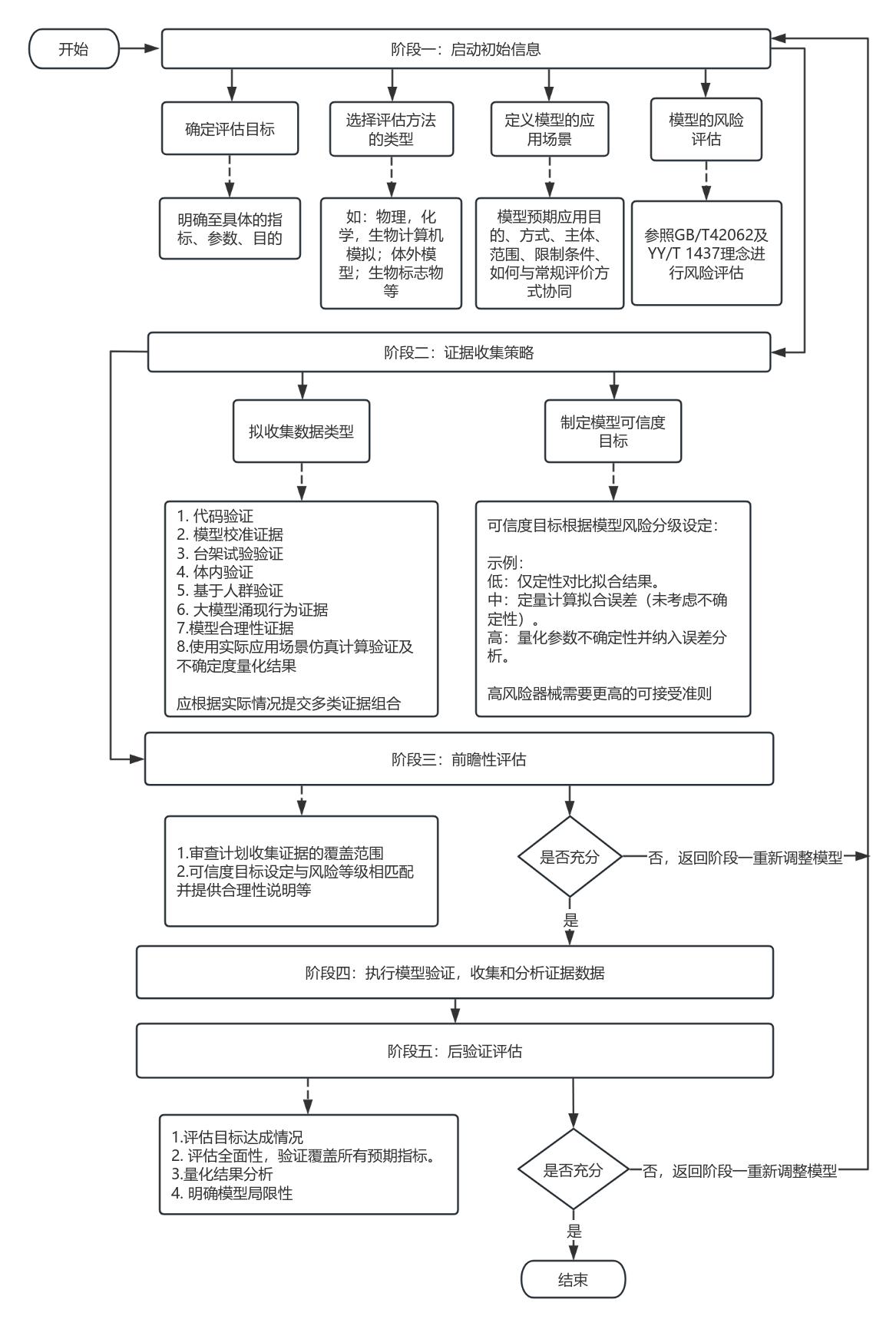
图1 应用纳米材料的医疗器械计算机模型形成流程图
(四)生物相容性研究项目中新兴技术方法的应用及相关要求
1. 化学表征
应用纳米材料的医疗器械化学表征研究应满足GB/T 16886.18、《医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则》与《医疗器械未知可沥滤物评价方法形成及表征技术审查指导原则(征求意见稿)》的要求,应对器械的接触性质、构造、材料组成与加工工艺等信息开展收集与评估,科学地选择研究方法并开展方法学验证,此外还应结合《应用纳米材料的医疗器械安全性与有效性评价指导原则 第二部分:理化表征》中的要求,对器械中材料的纳米特性开展表征。结合产品临床使用方式对所获表征数据开展适当的应用,为产品整体风险评估提供毒理学关注点,补充解释某些生物学试验结果或增加某些评估终点。
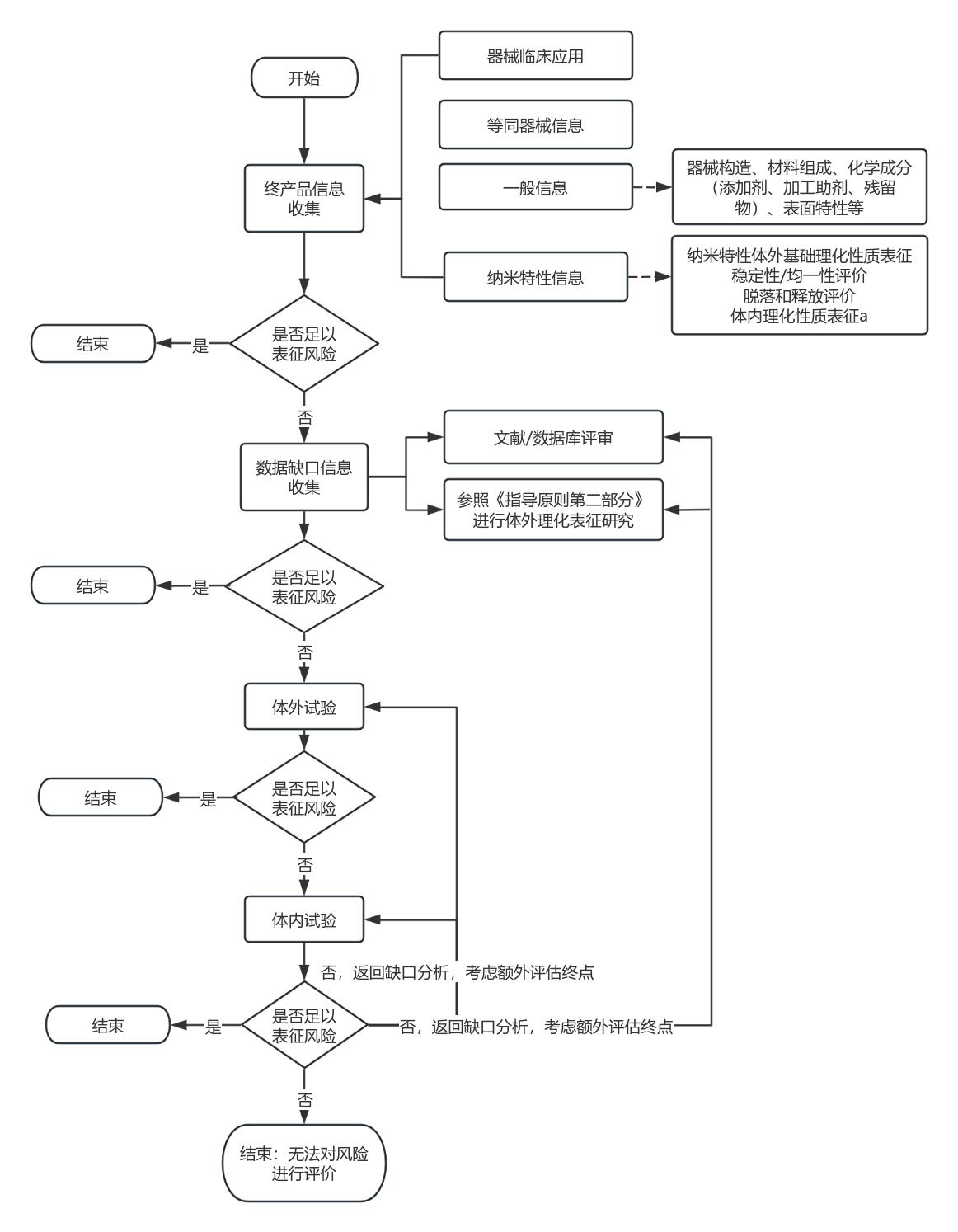
图2 应用纳米材料的医疗器械分层研究流程图
2.刺激性
刺激性试验的体外评价方法已形成标准化测试方法,包括体外细胞模型、3维重建皮肤模型、化学研究等。其标准化方法有皮肤腐蚀试验(如OECD 431重组人表皮模型的皮肤腐蚀性试验)、皮肤刺激试验(如OECD439重建皮肤模型刺激性试验)、经皮肤吸收试验(如OECD428 透皮吸收 体外试验方法)、眼刺激试验(如OECD 460 荧光素渗漏试验、OECD 491 兔角膜上皮细胞短时暴露试验、OECD 263 眼刺激与眼损伤测试评估综合方法指南)等。
现已验证的体外皮肤模型与人体皮肤在组织结构与活力上具有高度一致性,但目前的模型仍具有缺乏皮肤附属结构、组织结构单一、屏障功能弱等缺陷,不适用于对机体系统相互作用、长期接触评估等方面开展评估。因为体外评价方法的局限性,对刺激性的评估可能需要按照基于多方法结合及分层评估策略。
注册申请人对应用纳米材料的医疗器械刺激性终点评估可选择通过上述标准化方法/方法组合或针对产品特殊机制或某作用靶点开发新体外评价方法,但应提供充分的方法选择理由与方法适用性证明。
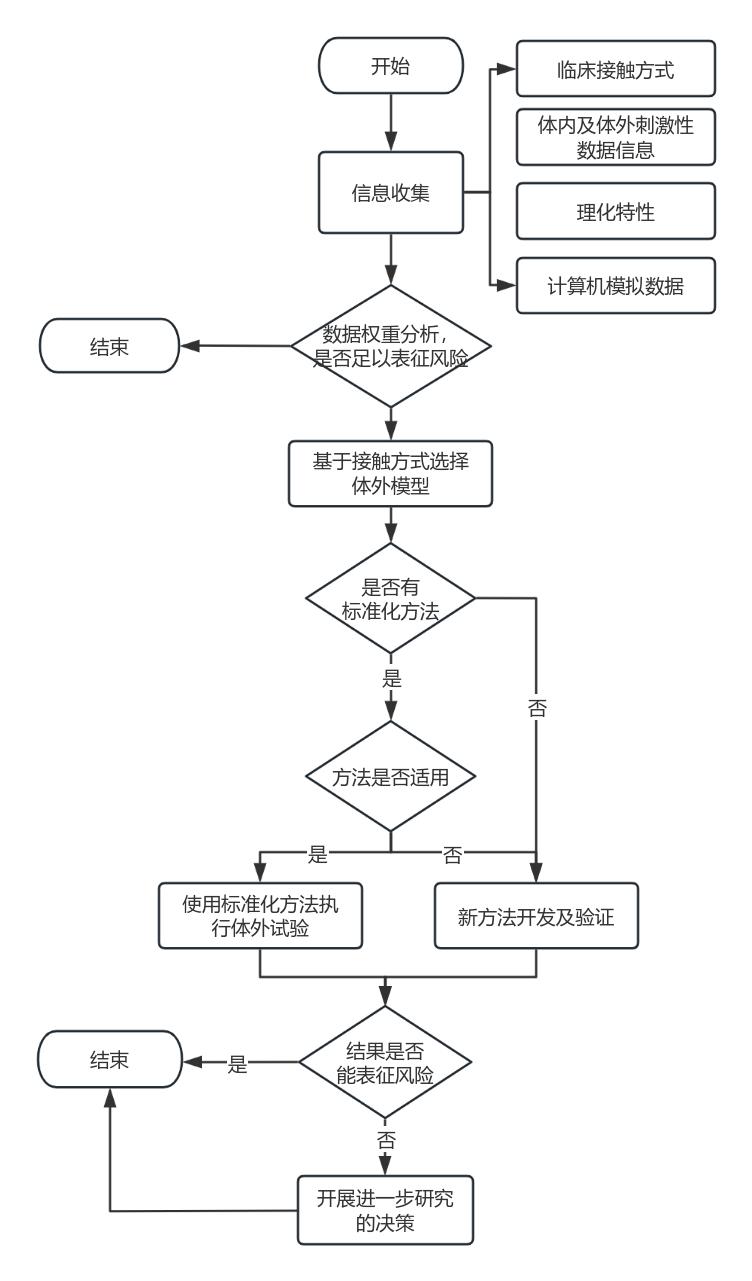
图3 应用纳米材料的医疗器械生物相容性分层研究决策流程图
2.皮肤致敏
潜在的皮肤致敏风险可通过根本事件作为评估根本的一系列标准化试验方法组合开展评价,如直接多肽反应试验(OECD 442C,评估蛋白质结合)、树突细胞激活试验(OECD 442E)、角质形成细胞激活试验(OECD 442D)等,任何一个单独的试验都不足以准确评估材料的致敏潜能,注册申请人应选择组合测试策略作为集成的评估方法,如皮肤致敏的有害结局(Adverse Outcome Pathway, AOP)框架(OECD 497),推荐在蛋白质结合、角化细胞活化、树突状细胞激活中选择2项根本事件开展评估的组合策略。任何试验方法与组合策略的选择均需要提供适用性依据。
3.血液相容性
血液相容性应基于产品的临床应用途径,按照GB/T 16886.4的要求选择相应的评价终点。标准化的血液相容性试验方法均以体外试验为主,包括对血细胞、血小板、补体、凝血功能与血栓形成的各类指标评估。当标准方法不足以评估材料、需要开展方法优化、或与血液相互作用风险或需要进一步阐明产品作用机制时,推荐注册申请人按照器械形态、用途、体内接触方式开发、验证、应用更具特异性的体外试验模型。
4.植入反应
目前尚不支持使用体外评价方法对植入试验开展替代,但鼓励注册申请人使用体外评价试验提供额外的信息。如用于模拟血管生理与形态学的血管芯片,在应用于血管支架组织相容性的评价上,可在材料早期评估中快速提供局部组织相容性证据。
5.全身毒性研究
体外试验一般认为尚不适用于全身毒性的评估,但体外试验数据(如肝毒性、肾毒性模型)、计算毒理学(QSAR)与暴露评估可为全身毒性风险评估提供补充信息,对于前期研究中发现的毒性风险,注册申请人可考虑使用体外模型对毒性作用机制开展深入研究。以下列举部分可能适用的替代方法案例:
5.1 应用类器官(Organoids)为全身毒性研究提供人源性组织的生物学、疾病建模、有效性评估以及毒理学的研究信息。
5.2 应用器官芯片/微生理系统(Micro-Physiological System, MPS)模拟不同组织的生理特征,提供纳米材料与组织反应的过程与机理的研究行为,如通过肝芯片研究纳米材料在肝组织中的代谢;通过血脑屏障芯片、胎盘屏障芯片研究纳米材料对屏障的穿透性能;通过相关靶组织芯片,研究纳米材料对各类靶器官毒理机制;通过皮肤芯片,研究纳米材料穿透皮肤屏障潜能;通过免疫芯片,研究纳米材料对免疫系统的作用机理。
5.3 类器官芯片(Organoids-on-chips)模拟多种器官相互作用的复杂生理功能,可按照医疗器械应用场景与风险评估目的选择类器官组合,如肠、肝类器官组合,可用于模拟化合物的吸收(肠)与代谢(肝)。
器官芯片/类器官芯片尚未形成标准化产业,注册申请人在使用该工具开展研究时,需关注其特质要素,提供相关模型验证材料,如器官芯片的结构设计、细胞来源、制备工艺、模型构建与功能验证等。
6.毒代动力学
毒代动力学研究提供纳米材料医疗器械降解产物与可沥滤物在体内的吸收、分布、代谢与排泄过程,此类研究常选择通过标记开展体内产物追踪或化学研究的方法,但注册申请人应对标记方式的有效性与检出限开展验证。体外评价模型不能替代体内研究,但鼓励注册申请人应用体外模型为毒代动力学研究提供更多的信息。以器官芯片为例,该方法可用于药械组合产品中药物动力学(Pharmacokinetics,PK)与药效(Pharmacodynamics,PD)研究,在体外形成生理与病理模型以评估药动学、药效与作用机制等。通过基于药动与药效两者内在联系构建可靠的数学模型,可以形成剂量-浓度-生物标志物-药效指标的定量关系,评估纳米材料在体内的暴露浓度、强度、持续时间及频率等,揭示化合物内在特性,并科学外推预设条件下的未知结果。
7.致癌性
遗传毒性体外试验组合选择应符合《应用纳米材料的医疗器械安全性与有效性 评价指导原则第三部分:生物相容性/毒理学评价》的要求,但遗传毒性仅适用于识别DNA反应性致癌物,非遗传毒性致癌物难以评估。注册申请人可基于已有数据库使用计算机模拟工具对产品致癌性风险初步评估。可考虑使用标准化的体外细胞转化试验对材料致癌性潜能开展初筛(如OECD 231体外Bhas 42细胞转化试验、体外SHE细胞转化试验)可考虑基于根本事件的理念对癌症出现的根本节点标志物开展研究,为致癌性风险提供更多的证据。
8.生殖毒性
生殖毒性试验仅适用于存在生殖系统暴露的情形,完整的生殖毒性试验包括生育力与早期胚胎发育毒性试验、胚胎-胎仔发育毒性试验与围产期毒性试验。现有3种不同的胚胎毒性检测方法,即全胚胎培养法(Whole embryo culture,WEC)、微团检测法(Micromass culture,MM)、胚胎干细胞检测法(Embryo stem cell test,EST),上述体外方法可快速排除高胚胎毒性物质。但现有方法仅针对胚胎毒性,无法全面评估生殖周期的所有阶段(如生育力、妊娠维持、子代发育),故不推荐使用体外生殖毒性研究完全取代体内生殖发育毒性试验,但注册申请人仍可考虑按照下述分层策略开展生殖发育毒性评估,减少不必要的动物实验:
初筛:通过体外试验排除强胚胎毒性物质。
进阶:结合现有机制数据(如激素干扰试验)补充生育力评估。
决策:对前两项获得阴性的物质使用动物体内研究以确保全面性。
推荐开发可评估生殖周期中的特定环节的体外方法(如Leydig细胞功能研究),以应用于毒性探索及机理研究资料。
(五)应用人工智能工具的相关要求
人工智能(Artificial intelligence,AI)工具,如基于马尔科夫链、遗传算法、Rossetta等技术的模型应参考国家药监局印发的《药品监管人工智能典型应用场景清单》,弄清楚了15 个重点应用场景以及器审中心发布的《人工智能医疗器械注册审查指导原则》,满足人工智能医疗器械全生命周期过程质控要求与注册申报资料要求。应按照上述指导原则对人工智能工具开展算法性能评估,满足其在权威性、科学性、规范性、多样性、封闭性、动态性方面的专用要求。
注册申请人应秉持科学与理性的态度,在应用纳米材料的医疗器械评价中,如准备按照基于人工智能工具,如大语言模型技术,需要基于对应用风险的深入了解,如技术安全风险,包括提示注入、数据泄漏、不改进的沙盒隔离等;数据隐私与安全风险,例如,用户数据被用于训练结果隐私信息泄露、模型与数据成为根本资产安全保护难度提升等;伦理与法律风险,例如,算法偏见与歧视、模型输出错误或虚假信息等,评估人工智能工具的适用性。注册申请人应紧密结合人工智能工具的技术特性、自身实际需求以及风险容忍度,开展审慎评估与规划。
四、参考文献
[1]国家药品监督管理局.医疗器械注册申报资料要求与批准证明文件格式:国家局公告2021年第121号[Z].
[2]THE U.S. FOOD AND DRUG ADMINISTRATION. Reporting of Computational Modeling Studies in Medical Device Submissions, 2016[R].
[3]THE U.S. FOOD AND DRUG ADMINISTRATION. Advancing New Alternative Methodologies at FDA, 2021[R].
[4]THE U.S. FOOD AND DRUG ADMINISTRATION. Advancing Regulatory Science at FDA: FOCUS AREAS OF REGULATORY SCIENCE (FARS), 2021[R].
[5]THE U.S. FOOD AND DRUG ADMINISTRATION. Successes and Opportunities in Modeling & Simulation for FDA, 2023[R].
[6]骨科金属植入物有限元研究资料注册技术审查指导原则
[7]医疗器械动物试验研究注册审查指导原则第一部分:决策原则(2021年修订版)(2021年第75号)
[8]《D5.1 类器官与类器官相关技术领域的操作指南》(D5.1 Operational Guidelines for the Field of Organoids and Organoid-Related Technologies)
[9]《D6.1类器官与类器官相关活动的监管:监管缺口与过度监管领域的研究》(D6.1 Regulating Organoid and Organoid-related Activities: an Analysis of the Regulatory Gaps and Areas of Over-regulation)
[10] THE U.S. FOOD AND DRUG ADMINISTRATION. Biocompatibility and Toxicology Program: Research on Medical Devices, Biocompatibility, and Toxicology
[11] THE U.S. FOOD AND DRUG ADMINISTRATION. The Credibility of Computational Models Program: Research on Medical Devices, Biocompatibility, and Toxicology
[12] THE U.S. FOOD AND DRUG ADMINISTRATION. Assessing the Credibility of Computational Modeling and Simulation in Medical Device Submissions
[13] European Medicines Agency. Non-Clinical and New Approach Methodologies European Specialised Expert Community
[14] THE U.S. FOOD AND DRUG ADMINISTRATION. Medical Device Development Tools (MDDT)
[15] THE U.S. FOOD AND DRUG ADMINISTRATION. Advancing Alternative Methods for Regulatory Use
[16] THE U.S. FOOD AND DRUG ADMINISTRATION. Perspectives on Evaluating New Toolsfor Regulatory Use
[17] 中国生物工程学会团体标准 器官芯片 通用术语 T/CSB 0003-2024
[18] Assessing the Credibility of Computational Modeling and Simulation in Medical Device Submissions FDA 2023
[19] Qualification of Medical Device Development Tools FDA 2023
[20]《药品监管人工智能典型应用场景清单》
[21] 《人工智能医疗器械注册审查指导原则》
[22] 陈锋,吴欣然.大语言模型在药品监管中的应用实践与思考[J].中国食品药品监管.2025.3(254):4-13.
附录1相关名词解释
新兴技术方法(New Approach Methodologies,NAMs):可通过避免使用完整动物开展测试而提供化学品危害与风险评估信息的任何技术、方法或其组合。
体外In Vitro:即在活体生物之外的人工环境中开展的实验。如使用微生物、细胞在人工环境中开展实验。
离体 Ex Vivo:即在外部环境(活体外)的生物体组织中开展的实验,对自然条件的改变最小。一个例子是在实验室灌注一个完整的肝脏,以确定化学物质是如何在肝脏中被处理的。
体内In Vivo:即使用整个活生物体开展的实验。
类器官(Organoid):干细胞或器官特异性前体细胞通过体外增殖、分化与自组织等方式形成的,具有多种细胞类型及特定细胞排布的三维微组织。
器官芯片(Organ-on-a-chips,OoCs):通常包括多种细胞、功能组织界面、生化因子以及生物力(如流体剪切力、牵张力)等根本要素,可在体外模拟器官的根本功能特征,反映器官对药物或环境因素等刺激的响应。
人体器官芯片(Human Organs-on-chips,H-OoCs):模拟人体器官主要结构与功能单元的微型细胞培养器件。
多器官芯片(Multi-organs-on-a-chips,MOoCs):模拟两个及以上特定组织或器官间功能关联特征的器官芯片。
类器官芯片(Organoid-on-a-chip, Organoids-on-chips,OoC-Os):以类器官作为细胞来源构建的器官芯片。
微生理系统(Micro-Physiological System, MPS):模拟人体器官生理、病理特征的微系统。通常包括细胞生长条件(如温度、pH与氧气)、生物化学因素(如分子浓度梯度、生长因子)以及生物物理因素(如流体剪切力、牵张力)等微环境要素,可以模拟机体健康与疾病状态,反映人体对药物或环境因素等刺激的响应。
微流控芯片(Microfluidic chip):利用微加工技术在硅、石英或高分子材料等基底上加工微结构,如微通道、微泵、微阀等功能单元,开展流体操控、样品处理与研究的微系统。
人工智能(Artificial intelligence, AI):广义上定义为制造智能机器,尤其是智能计算机程序的科学与工程。人工智能可以使用不同的技术,包括基于数据统计研究的模型、主要依赖if-then语句的专家系统以及机器学习。
计算机模拟(In silico):基于材料的理化特性决定生物效应这一要是,应用数学建模与计算机模拟等方式来预测化学物、混合物与纳米材料等物质毒性。



 1161
1161

