【产品名称】六项泌尿生殖系统感染病原体核酸检测试剂盒(荧光PCR 法)
【包装规格】50 测试/盒
【预期用途】
本产品用于体外定性检测泌尿生殖道拭子样本中的6 种病原体核酸,包括沙眼衣原体、淋病奈瑟菌、解脲支原体(Uu)、生殖支原体、单纯疱疹病毒Ⅱ型、阴道毛滴虫。
结合临床表现与其他实验室指标,本产品的检测结果可用于泌尿生殖道相关病原体感染的辅助诊断。
性传播疾病(SexuallyTransmittedDiseases,STD)是一种全球性流行病,不仅影响患者个人及其性伴侣的性健康与生殖健康,还影响新生儿与儿童的生命健康,造成了严重的公共卫生负担,影响着全世界人民的健康与生活。淋病是我国性传播疾病的主要病种之一,由淋病奈瑟菌(NeisseriaGonorrhoeae,NG)感染所致[1-2]。非淋菌性尿道炎即由淋病奈瑟菌以外的其他病 原体,主要是解脲支原体(Ureaplasma urealyticum,Uu),沙眼衣原体(Chlamydia Trachomatis,CT),生殖支原体(Mycoplasma Genitalium,MG)等病原微生物所引起的泌尿生殖道急慢性炎症[3]。其他病原体还包括阴道毛滴虫(TrichomonasVaginalis,TV)与单纯疱疹病毒Ⅱ型(HerpesSimplexVirus 2,HSV-2)等[4]。上述泌尿生殖系统病原体感染引起的临床症状与体征都较为相似,其临床表现主要为尿道炎、宫颈炎、盆腔炎、阴道炎、附睾炎、前列腺炎、生殖器溃疡等症状,严重的会结果生育能力下降,甚至不孕不育,增加了罹患或传播艾滋病毒感染的风险,但不同病原体引起的感染,其治疗方法、疗效与病程也不尽一致,因此及时弄清楚生殖道感染患者的病原体类型,对于进一步诊疗工作具有根本的作用。
【检验原理】
本试剂盒按照基于多重荧光PCR技术与熔解曲线研究相结合的方法,通过多条特异性引物对沙眼衣原体、淋病奈瑟菌、解脲支原体、生殖支原体、单纯疱疹病毒Ⅱ型与阴道毛滴虫的核酸序列中保守区域片段开展PCR扩增,扩增产物与带有特异性标记的探针结合,不同病原体的产物所对应探针的Tm 值不同,通过熔解曲线研究可以鉴别出样本中病原体的种类。
本试剂盒包括内部质控(IC)与扩增质控(AC),内部质控(IC)监控核酸的提取以及整个反应过程,扩增质控(AC)监控第二步反应过程。
【主要组成成分】
组分名称 | 主要组成成分 | 标示量 |
STD6 反应酶1 | Taq酶 | 60μL/管×1 |
STD6引物 | 引物、dNTPs | 770μL/管×1 |
STD6 缓冲液 | 引物、探针、dNTPs、扩增质控(AC) | 1050μL/管×1 |
STD6 反应酶2 | Taq酶 | 60μL/管×1 |
STD6内部质控 | 噬菌体 | 280μL/管×1 |
STD6阳性质控1 | 生殖支原体核酸片段与阴道毛滴虫核酸片段 | 110μL/管×1 |
STD6阳性质控2 | 淋病奈瑟菌核酸片段、沙眼衣原体核酸片段、解脲支原体核酸片段与单纯疱疹病毒Ⅱ型核酸片段 | 110μL/管×1 |
稀释液 | 超纯水 | 1700μL/管×1 |
注:不同批号试剂盒中各组分不能互换。
需要然而未提供的试剂:
核酸提取试剂(上海捷诺生物科技股份有限公司,沪徐械备20210006 号,货号:JQ1),或QIAamp DNA Blood Mini Kit(凯杰德国 QIAGEN GmbH,货号:51106 或51104)。
【储存条件及失效期】
-15℃及以下保存,有效期12个月。
冻融不应超过5次,超过5次后应该舍弃。
生产日期、有效期至见标签。
【适用仪器】
实时荧光定量 PCR 仪 LightCycler 480(罗氏诊断公司,国械注进 20163222935,型号:LightCycler 480Ⅱ)
【样本要求】
1. 样本类型:泌尿生殖道拭子样本:男性为尿道拭子,女性为宫颈拭子。
2. 样本拭子要求:男用采样拭子的头为人造棉,杆为不锈钢材质;女用采样拭子的头为脱酯棉、涤纶、人造棉材质,杆为塑料、木头材质。
3. 样本采集方法:使用一次性采样拭子采样后,放入2mL的生理盐水,密闭送检。
4.样本保存
采集的标本应及时送检:室温(18~26℃) 保存应不超过 48 小时;2~8℃保存应不超过 7 天;-20±5℃保存不超过3 年;-70℃及以下保存不超过4 年;反复冻融次数不应超过5次。
提取后的核酸样本-20±5℃保存不超过2 年,反复冻融次数不超过5 次。
【检验方法】
检验前准备:颜色补偿
因为不同染料的发射光谱存在重叠,不同颜色通道会出现干扰。因为避免色谱的重叠,每台实时荧光定量PCR仪首次使用本试剂盒开展检测前,需要开展颜色补偿。按照《颜色补偿试剂说明书》开展操作,生成颜色补偿文件。
操作步骤:
1.核酸提取
样本处理:每200μL样本加5μL STD6内部质控,之后提取核酸。
阴性对照:每次实验均需设置阴性对照,200μL稀释液加5μL STD6内部质控,与样本一起开展核酸提取及后续操作。
按照核酸提取试剂说明书开展提取,洗脱体积60μL用于后续检测。
2.第一步反应
2.1配制
从试剂盒中取出STD6反应酶1与STD6引物,在室温下融化并充分混匀后,瞬时离心备用;
计算测试数n[n=样本数+阴性对照+阳性对照+1]。
第一步反应体系(每测试)配制如表1:
表1.第一步反应体系
组分 | 体积(μL/测试) |
STD6 反应酶1 | 1 |
STD6引物 | 14 |
总体积 | 15 |
配制完成后,充分混匀,瞬时离心,按15μL/测试分装到PCR反应管中。
2.2加样
从试剂盒中取出STD6阳性质控1与STD6阳性质控2(即阳性对照),在室温下融化并振荡混匀后,瞬时离心备用。
将处理后的待测样本核酸、阴性对照核酸、STD6阳性质控1与STD6阳性质控2分别加10 μL到各自PCR反应管中,加样后,盖上管盖,立即充分混匀并瞬时离心。
2.3设置第一步反应程序
按照表2程序开展PCR反应:
表2.第一步反应程序参数
温度 | 时间 | 循环数 |
95℃ | 2 min | 1 |
94℃ | 20sec | 40 |
55℃ | 20sec | |
72℃ | 35sec | |
37℃ | Holding | 1 |
3.第二步反应
3.1配制
从试剂盒中取出STD6反应酶2与STD6缓冲液,在室温下融化并充分混匀后,瞬时离心备用;
计算测试数n[n=样本数+阴性对照+阳性对照+1]。
第二步反应体系(每测试)配制如表3:
表3.第二步反应体系
组分 | 体积(μL/测试) |
STD6 反应酶2 | 1 |
STD6 缓冲液 | 19 |
总体积 | 20 |
配制完成后,充分混匀,瞬时离心,按20μL/测试分装到PCR反应管中。
3.2加样
1)从PCR仪中取出第一步反应产物,短暂离心,小心打开PCR管盖;
2)取5μL第一步反应产物,加入PCR反应管;
3)盖上管盖,充分混匀,短暂离心;
4)放入实时荧光定量PCR仪,运行第二步反应程序。
3.3设置第二步反应程序
按照表4设置检测通道,按照表5设置PCR反应程序:
表4.PCR检测通道设置
检测通道 | 激发波长(nm) | 检测波长(nm) |
FAM | 465 | 510 |
ROX | 465 | 610 |
Cy5 | 465 | 660 |
表5.第二步反应程序参数
温度 | 时间 | 循环数 | 备注 |
95℃ | 2 min | 1 | / |
94℃ | 15sec | 10 | / |
55℃ | 15sec | ||
72℃ | 15sec | ||
94℃ | 15sec | 23 | / |
50℃ | 15sec | ||
72℃ | 15sec | ||
95℃ | 2 min | 1 | / |
40℃ | 90sec | 1 | / |
40~90℃ | ---- | 1 | 熔解程序,荧光检测1 Acquisitions/℃ |
37℃ | 1sec | 1 | / |
4.研究程序设置
4.1 程序运行结束后,软件中点击“Analysis”,选择“Tm calling”,点击“√”开展确定。
4.2 点击“Color Comp(Off)”右侧的下拉菜单,点击“InDatabase”。选择颜色补偿时形成的文件,点击“√”,显示“ColorComp(On)”。
4.3 点击“Filter Comb(465-510)”,选择ROX(465-610),点击“Calculate”,研究ROX通道。
4.4 点击“Filter Comb(465-510)”,选择Cy5(465-660),点击“Calculate”,研究Cy5通道。
4.5 点击“Filter Comb(465-510)”,选择FAM(465-510),点击“Calculate”,研究FAM通道。
5.质量控制
5.1阴性对照:阴性对照在ROX与Cy5通道均不能出现病原体特异性峰,并且在FAM通道同时
出现IC与AC负峰(如图1),Tm值范围见表6,则本次实验有效。否则,需重复实验。
1)内部质控(IC):用于监控核酸的提取以及整个反应过程。
2)扩增质控(AC):用于监控第二步反应过程。
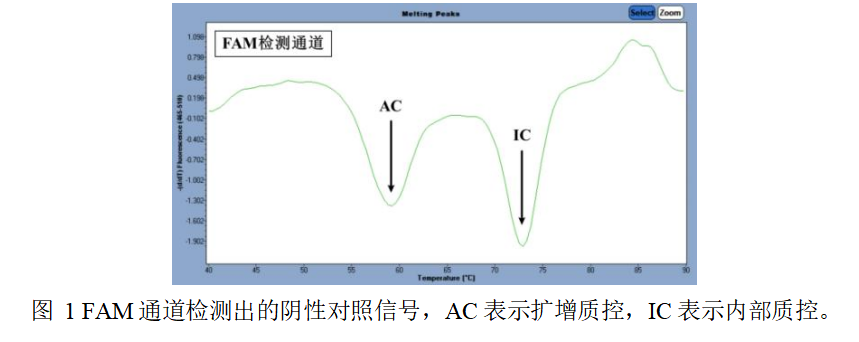
表6.IC与AC的Tm值
ROX (465-610) | Cy5 (465-660) | FAM(465-510) | |
Tm范围(℃) | 靶标 | ||
无特异性峰 | 无特异性峰 | 71.5~74.5 | IC |
57.0~60.0 | AC | ||
5.2阳性对照:STD6阳性质控1 与STD6阳性质控2 在ROX 与Cy5 通道均能检测出对应的病原体,
表明阳性对照成立;否则,阳性对照不成立,需重复实验。其判读指标如图2-3与表7-8:
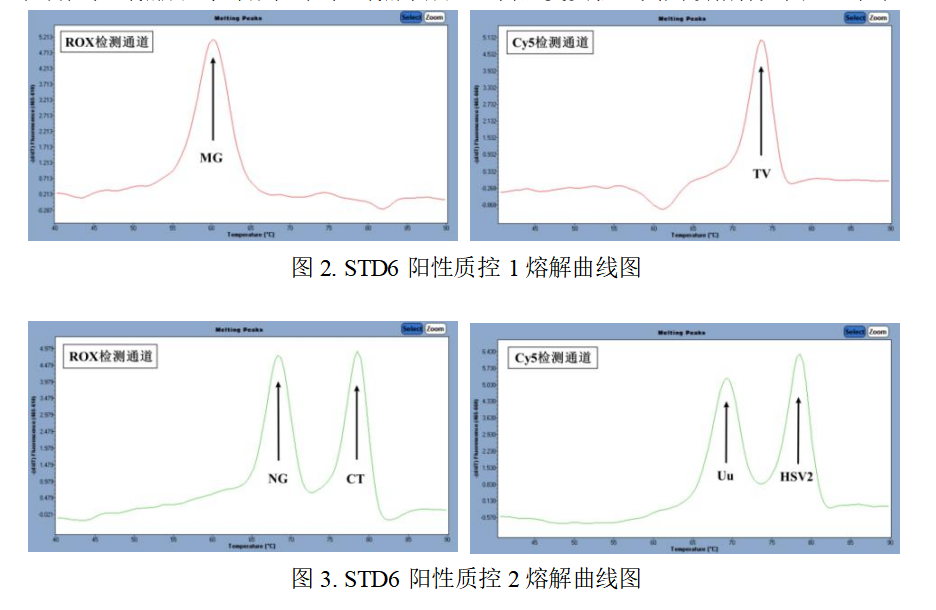
表7.STD6阳性质控1 Tm值
检测通道 | Tm值范围(℃) | 病原体(靶标) |
ROX(465-610) | 59.0~62.0 | 生殖支原体(MG) |
Cy5(465-660) | 71.5~74.5 | 阴道毛滴虫(TV) |
表8.STD6阳性质控2 Tm值
检测通道 | Tm值范围(℃) | 病原体(靶标) |
ROX(465-610) | 67.5~70.5 | 淋病奈瑟菌(NG) |
77.5~80.5 | 沙眼衣原体(CT) | |
Cy5(465-660) | 67.0~70.0 | 解脲支原体(Uu) |
77.5~80.5 | 单纯疱疹病毒Ⅱ型(HSV-2) |
【阳性判断值】
通过对996 例样本开展检测,研究统计样本检测结果的Tm 值,形成本试剂盒检测范围内六项泌尿生殖系统感染病原体的Tm 值范围,本产品的阳性判断值如下表所示:
表9. 阳性判断值
检测通道 | Tm值范围(℃) | 病原体(靶标) |
ROX (465-610) | 59.0~62.0 | 生殖支原体(MG) |
67.5~70.5 | 淋病奈瑟菌(NG) | |
77.5~80.5 | 沙眼衣原体(CT) | |
Cy5 (465-660) | 67.0~70.0 | 解脲支原体(Uu) |
71.5~74.5 | 阴道毛滴虫(TV) | |
77.5~80.5 | 单纯疱疹病毒Ⅱ型(HSV-2) | |
FAM (465-510) | 71.5~74.5 | 内部质控(IC) |
57.0~60.0 | 扩增质控(AC) |
【检验结果的解释】
1. 在阴性对照与阳性对照均正常的情况下,针对每个待检样本开展结果判定。
阳性结果:检测通道ROX与/或Cy5存在特异性峰,按照特异性峰的Tm值,参照表9判定其病原体阳性。
阴性结果:检测通道ROX及Cy5无特异性峰,则参照表9判定质控通道FAM是否存在IC与AC。要是同时存在,表明样本为阴性;否则需重复该样本实验。
2. 当ROX与Cy5通道均为阴性检测结果时,需检查FAM通道IC与AC的结果,以判定样本检测结果是否有效;当ROX或Cy5通道出现阳性检测结果时,不对FAM通道的结果开展判读。
3. 可能出现的各种实验结果及解释见表10:
表10.实验结果解释
反应体系 | 实验结果解释 | |||
ROX | Cy5 | FAM | ||
IC | AC | |||
+ | - | / | / | 反应体系的ROX阳性检测结果有效 |
- | + | / | / | 反应体系的Cy5阳性检测结果有效 |
+ | + | / | / | 反应体系的ROX 与Cy5阳性检测结果有效 |
- | - | + | + | 阴性结果 |
- | - | - | - | 检测结果无效 |
- | - | - | + | 核酸提取失败或未加入样本,检测结果无效 |
备注:+表示存在特异性峰,-表示不存在特异性峰,/表示当其他条件满足时,该荧光通道结果可不作考虑。
【检验方法的局限性】
1.本试剂盒检测结果仅供临床参考,不作为临床感染诊断的唯一依据。
2. 当检测样本被检核酸浓度含量低于最低检测限时可能会有假阴性结果,阴性结果仅能说明低于本试剂盒检测限值,不能完全排除感染的可能,此时建议按照基于其他方法进一步确认。
3.待测目标序列的变异或其它原因结果的序列改变可能会结果不正确的检测结果。
4.样本检测结果与样本收集、处理、运送以及保存质量密切相关,实验室环境污染、试剂污染、样 本交叉污染会结果假阳性;试剂运输或保存不当造成的试剂检测性能下降会结果假阴性结果。
5.本试剂盒按照基于外源性内部质控,在提取之前加入,用于监测样本提取与PCR扩增过程,不能监测取样过程。样本采集不可靠可能会结果假阴性结果。
【产品性能】
1.阴性参考品符合率
对国家参考品开展检测,不在试剂盒检测范围内的病原体均不检出;对企业阴性参考品开展检测,检测结果均为阴性。
2.阳性参考品符合率
对国家参考品开展检测,检测结果符合国家参考品标准且与已知的病原体种类相符;对企业阳性参考品开展检测,检测结果均为阳性。
3.重复性
对国家参考品开展检测,检测结果符合国家参考品标准且与已知的病原体种类相符,且Tm值的变异系数(CV,%)均≤2.0%;对企业重复性参考品开展检测,检测结果与已知的病原体种 类相符,且Tm值的变异系数(CV,%)均≤2.0%。
4.精密度
按照基于三批试剂分别对中强阳、弱阳性样本开展批内、批间、日内、日间、不同操作者、不同地点间的精密度研究,检测结果与已知的病原体种类相符,且Tm值的变异系数(CV,%)均≤2.0%。
5.最低检出限
对国家参考品开展检测,检测结果符合国家参考品标准且与已知的病原体种类相符。对企业最低检出限参考品(S1~S9)开展检测,检测结果均为阳性。
按照产品性能评估结果,确定本试剂盒的最低检出限(LoD),如表11。
表11.各病原体最低检出限
病原体(靶标) | 拷贝浓度 | 活性单位浓度 |
生殖支原体(MG) | 150 copies/mL | 60个/mL |
淋病奈瑟菌(NG) | 100 copies/mL | 75 CFU/mL |
沙眼衣原体(CT) | 100 copies/mL | 60 IFU/mL |
解脲支原体(Uu) | 100 copies/mL | 100 CCU/mL |
阴道毛滴虫(TV) | 100 copies/mL | 75 cells/mL |
单纯疱疹病毒Ⅱ型(HSV-2) | 100 copies/mL | 60 TCID50/mL |
6.研究特异性
6.1交叉反应
试剂盒与人乳头瘤病毒16型、人乳头瘤病毒18型、人乳头瘤病毒52型、人类免疫缺陷病毒1型、单纯疱疹病毒Ⅰ型、梅毒螺旋体、表皮葡萄球菌、大肠杆菌、热带念珠菌、人腺病毒5型、巨细胞病毒、化脓性链球菌、水痘-带状疱疹病毒、EB病毒、人肠道病毒 71 型、人类疱疹病毒8型、乙型溶血性链球菌、杜克雷嗜血杆菌、厌氧肽链球菌、嗜酸乳杆菌、粪肠球菌、屎肠球菌、金黄色葡萄球菌、光滑念珠菌、近平滑念珠菌、白色念珠菌、阴道阿托波菌、阴道加德纳菌、人型支原体、细小脲原体、脆弱拟杆菌、惰性乳杆菌、詹氏乳杆菌、格氏乳杆菌、卷曲乳杆菌、羞怯动弯杆菌、克氏动弯杆菌、干酪乳杆菌、人基因组无交叉反应。
6.2干扰物质
宫颈拭子样本含有以下干扰物质对检测结果无影响:20μg/mL胆红素、10mg/mL四环素、0.1mg/mL阿奇霉素、10μg/mL螺旋霉素、0.1mg/mL罗红霉素、0.1mg/mL米诺环素、1mg/mL磺胺嘧啶、2mg/mL氢化可的松、0.3mg/mL地塞米松、20μg/mL阿昔洛韦、50mg/mL更昔洛韦、60μg/mL盐酸多西环素、0.1mg/mL阿莫西林、20mg/mL甲硝唑片、5mg/mL重组干扰素α2b凝胶、0.15 mg/mL左炔诺孕酮片、50 mg/mL替硝唑阴道片、15%(v/v)复方黄松洗液、10 mg/mL壬苯醇醚栓、174mg/mL保妇康栓、15%(v/v)人体润滑液啫喱、15%(v/v)梵密灵盐水清洗液、10mg/mL硝酸咪康唑乳膏。
尿道拭子样本含有以下干扰物质对检测结果无影响:20μg/mL胆红素、10mg/mL四环素、0.1mg/mL阿奇霉素、10μg/mL螺旋霉素、0.1mg/mL罗红霉素、0.1mg/mL米诺环素、1mg/mL磺胺嘧啶、2mg/mL氢化可的松、0.3mg/mL地塞米松、20μg/mL阿昔洛韦、50mg/mL更昔洛韦、60μg/mL盐酸多西环素、0.1mg/mL阿莫西林、20mg/mL甲硝唑片、5mg/mL重组干扰素α2b凝胶。
7.包容性
按照基于3批试剂对不同亚型/型别生殖支原体、淋病奈瑟菌、沙眼衣原体、解脲支原体、阴道毛滴虫、单纯疱疹病毒Ⅱ型开展包容性验证,重复性与检出限验证均符合要求,试剂盒包容性良好。
8.临床试验
本试剂在6家临床试验机构完成了临床试验,有效病例3511例。
试验体外诊断试剂与比较试剂开展比较研究:针对生殖支原体,阳性符合率为100.00%,阴性符合率为99.82%;针对淋病奈瑟菌,阳性符合率为99.74%,阴性符合率为99.81%;针对沙眼衣原体,阳性符合率为99.56%,阴性符合率为99.90%;针对解脲支原体,阳性符合率为100.00%,阴性符合率为100.00%;针对单纯疱疹病毒II型,阳性符合率为100.00%,阴性符合率为99.97%。
针对阴道毛滴虫,按照基于试验体外诊断试剂与一代测序开展比较研究:阳性符合率为100.00%,阴性符合率为99.91%。同时与已上市同类产品的比较,阳性符合率为100.00%,阴性符合率为100.00%。
【注意事项】
1.本产品仅限用于体外诊断。
2.操作人员应该在具有安全防护的实验室操作且需要穿戴相应的防护装备。
3.本产品中可能含有对人体有害或引起不适的化学物质,使用时避免皮肤直接接触。
4.试剂或样本如不慎与皮肤接触、溅入眼睛、被吸入等,应迅速用大量水冲洗。
5.实验如遇故中断,可能会对结果产生影响,应重新操作。
6.所有检测样品应视为具有传染性物质,实验过程中应穿工作服,使用一次性手套并经常替换 以免交叉污染;样本操作、废弃物处理均需符合相关法规要求:卫生部《微生物生物医学实验室生物安全通用准则》与《医疗废物管理条例》。
7.整个检测过程应分四个区域开展:试剂准备区、样本处理区、扩增区、产物研究区,各区使 用的仪器、设备、耗材与工作服均应独立专用,不得交叉使用。
【参考文献】
[1] 梅毒、淋病与生殖道沙眼衣原体感染诊疗指南(2020 年).
[2]樊尚荣,周小芳(编译).2015 年美国疾病控制中心性传播疾病的诊断与治疗指南(续)—淋病的诊断与治疗指南[J].中国全科医学,2015,18(26):3129-3131.FanSR,ZhouXF.CDC2015guideline for the diagnosis and treatment of gonorrhea[J].Chinese GeneralPractice,2015,18(26):3129- 3131.
[3] MoiH,BleeK,Horner PJ.Managementof non-gonococcal ure-thritis.BMCInfectDis,2015, 15:294.
[4]中华医学会男科学分会, 非淋菌性尿道炎诊疗指南(2022 版)编写组. 非淋菌性尿道炎诊疗指南(2022 版)[J].中华男科学杂志, 2022,28(5): 456-461.
【基本信息】
注册人/生产企业名称:上海捷诺生物科技股份有限公司住 所:上海市徐汇区银都路466 号3号楼1 层
联系方式:
售后服务单位名称:
联系方式:
生产地址:上海市徐汇区银都路466 号1 号楼201、203 室;
上海市徐汇区龙吴路2715号1幢104、106、108室;
上海市徐汇区银都路466 号3号楼1 层;上海市徐汇区银都路218 号3号楼一层。
生产许可证编号:
【医疗器械注册证编号/产品技术要求编号】【说明书批准日期/生效日期及修改日期】



 1097
1097

