
各密切相关单位:
为规范冠脉修饰球囊临床评价要求,经过前期调查研究、专家讨论,器审中心起草了《冠脉修饰球囊临床试验注册审查指导原则(征求意见稿)》(附件1),现向社会公开征求意见。
请填写反馈意见表(附件2),以邮件形式于2025年9月1日前按要求反馈至我中心相应联系人。邮件主题及文件名称请注明“《冠脉修饰球囊临床试验注册审查指导原则(征求意见稿)》意见反馈+反馈单位名称”。
联系人:王泽华、崔馨月
电话:010-86452502、010-86452521
电子邮箱:cuixy@cmde.org.cn
附件:1.冠脉修饰球囊临床试验注册审查指导原则(征求意见稿)(下载)
2.《冠脉修饰球囊临床试验注册审查指导原则(征求意见稿)》反馈意见表(下载)
国家药品监督管理局
医疗器械技术审评中心
2025年8月13日
附件一 冠脉修饰球囊临床试验注册审查指导原则(主任专题会汇报稿)
本指导原则旨在为监管部门对冠脉修饰球囊注册申报资料的技术审评提供技术指导,同时也为注册申请人开展该类产品的注册申报提供参考。
本指导原则是供注册申请人与技术审评人员使用的指导性文件,但不包括审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。要是有能够满足相关法规要求的其他方法也可以按照基于,然而需要提供详细的研究资料与验证资料。应在遵循相关法规与标准的前提下使用本指导原则。
本指导原则是在现行法规与标准体系以及当前认知水平下制定,随着法规与标准的不断改进以及科学技术的不断发展,本指导原则相关内容也将适时开展调整。
一、适用范围
临床上将“有修饰斑块作用的球囊”统称为修饰性球囊,通常包括切割球囊、 棘突球囊与刻痕球囊(包括双导丝、三导丝球囊),其原理有相似之处(切割球囊为显微外科刀片,棘突球囊为棘突棱,双导丝球囊为金属丝),该类产品分类编码为03-13-06,管理类别为第三类。该类产品在临床上通常定位于血管病变的预处理,具体适用场景包括:支架内再狭窄病变;开口病变;分叉病变;轻中度钙化病变或重度钙化病变经过旋磨等预处理后的情况;纤维性病变等常规球囊处理效果不佳的,经腔内影像确认后,使用常规球囊扩张后仍然效果不佳的情况。
本指导原则适用的修饰性球囊是通过局部应力集中原理,从而使得冠状动脉钙化病变等复杂病变有序断裂扩张,本指导原则不适用于其他原理或其他预期应用场景的特殊设计球囊,例如血管冲击波导管,乳突球囊扩张导管、螺旋球囊扩张导管、约束型球囊扩张导管、旋切/旋磨导管以及应用于外周血管、神经血管的修饰性球囊扩张导管等。上述相关产品可参照本指导原则中适用部分的要求。
如有符合我国注册相关要求的境外临床试验数据,在遵循伦理、依法、科学的原则下,保证数据科学、完整、充分时,可参照《接受医疗器械境外临床试验数据技术指导原则》作为临床试验资料提交,选择临床试验路径开展临床评价。
二、立题依据
申请人需结合临床应用需求等方面研究并弄清楚产品的立题依据,说明产品在设计上及临床前验证与临床确认方面如何满足临床一线的需要,并在综述资料或临床评价报告中提交相应资料。
三、临床试验设计
(一)临床试验目的
临床试验目的一般是评价申报产品在预期适用范围下对复杂斑块的预处理效果,以及使用一段时间后的安全性。
(二)临床试验基本设计类型
冠脉修饰性球囊通过凸出的刻痕丝、切割刀片或棘突棱实现局部的应力集中,临床一般定位于对复杂病变的预处理,该类产品技术比较成熟且对其适用疾病已有深刻了解,临床经验丰富,预期临床效果较为弄清楚,存在领域内较为公认的安全有效性指标所应达到的最低标准。冠脉修饰性球囊注册临床试验可开展单组设计或对照设计的临床试验。
(三)研究对象
临床试验需按照试验器械预期使用的目标人群,确定研究的总体人群。在综合考虑总体人群的代表性、伦理学要求、受试者安全性等因素的情况下,制定受试者的选择标准,即入选与排除标准。入选标准主要考虑受试对象对总体人群的代表性,如适应证、疾病的分型、疾病的程度与阶段、具体的使用部位、受试者年龄范围等因素。排除标准旨在尽可能规范受试者的同质性,将可能影响试验结果的混杂因素(如影响疗效评价的伴随治疗、伴随疾病等)予以排除,以达到评估试验器械效应的目的。具体需要考虑的要素如下:
一是入组人群需按照《冠状动脉球囊成形术与支架植入术操作规范》等临床指南、专家共识规范入组需要开展并且可开展经皮冠状动脉介入治疗(Percutaneous Coronary Intervention,PCI)的患者。具体入组与排除要求可参考《中国经皮冠状动脉介入治疗指南》(目前为2016版)与《冠状动脉球囊成形术与支架植入术操作规范》(目前为2022版)中的相关适用情形。
二是需按照产品设计特征与拟申报产品适应证等设定合适的其他入组排除条件,例如考虑参考血管直径,病变长度、病变成角等。目前已批准的用于冠脉狭窄病变治疗的支架及药物球囊产品适用的参考血管直径一般为2-4mm,修饰性球囊的直径选择应更保守,一般球囊与血管直径比不超过1∶1,建议比传统球囊直径小0.25mm,直径过大易造成严重夹层或穿孔。对于冠脉修饰球囊用于药物涂层球囊前的预处理、支架内再狭窄病变时,球囊与血管直径比建议为0.9∶1,原位病变为0.8∶1。对于切割球囊考虑到其通过性较差,且刀片可能引起血管的损伤问题,一般不适用于成角相较而言更多45的病变,故临床试验中不建议入组上述情况。
三是临床试验需入组与修饰性球囊临床定位相匹配的复杂病变。按照冠状动脉球囊成形术与支架植入术操作规范》,修饰性球囊的临床价值在于:
1.对于轻中度钙化等高阻力病变,修饰性球囊能够使内膜钙化断裂,提高扩张效果;
2.普通球囊无序扩张造成的撕裂容易结果夹层血肿,增加血管急性闭塞风险,修饰性球囊扩张后引导斑块撕裂多出现在血管长轴方向,从而减少限流性夹层形成;
3.修饰性球囊扩张容易固定于斑块表面,避免球囊滑脱,减少“西瓜子效应”(尤其是支架内再狭窄病变),减少正常节段的意外损伤。
因此推荐纳入的病变包括开口病变、分叉病变、轻中度钙化病变、支架内再狭窄、纤维性病变等常规球囊处理效果不佳的,经腔内影像确认后,使用常规球囊扩张后仍然预处理效果不佳等的情形。考虑到钙化病变是临床上最不利的典型病变情况,钙化病变比例需不低于50例且不低于总样本量的30%。若申请人拟申报慢性完全闭塞(Chronic Total Occlusion,CTO)及支架内再狭窄病变,需在临床试验有一定量入组,CTO病变数量宜不低于10例,支架内再狭窄病例宜不低于5例,若验证数量不足或结果不好的,需在适应证中弄清楚不适用。若临床试验中均纳入了钙化病变,则可覆盖开口病变与分叉病变,若未全部纳入钙化病变,则需要纳入一定数量的开口病变与分叉病变。开口分叉、分叉病变若未入组的或结果不佳的,适应证中需弄清楚不适用。
(四)评价指标
注册申请人在临床方案中均应对研究终点开展弄清楚的定义,提供确定依据,并应符合临床的常规诊疗。临床试验主要研究终点应选择具有临床意义的主要评价指标,并以此作为估算样本量的依据。
1.主要评价指标
应包括安全性与有效性评价指标。主要安全性评价指标建议为“术后14天内无主要心脏不良事件(Major Adverse Cardiovascular Events,MACE)的比率”,其中MACE包括全因死亡(心源性及非心源性),心肌梗死,靶病变血运重建,靶血管支架内血栓形成,有临床意义的心律失常(需干预的)。主要有效性评价指标建议考虑手术成功率,定义为“术后即刻残余狭窄率≤50%,且围术期内无死亡、无心肌梗死、无靶病变血运重建”。
2.次要评价指标
次要有效性及安全性评价指标建议考虑如下方面:
(1)30天内靶病变失败复合终点,即出现心源性死亡、靶病变相关的心肌梗死及临床驱动的靶病变血运重建;
(2)术后30天内患者相关的心血管临床复合终点,包括全因死亡、所有心肌梗死以及任何再次血运重建;
(3)术后30天内器械相关并发症,包括穿刺血肿、血管扩张后夹层、穿孔、急性闭塞等;
(4)预处理后病变准备成功率(术后即刻),即预扩张后靶病变的管腔残余狭窄<30%,心肌梗死溶栓治疗试验(Thrombolysis In Myocardial Infarction,TIMI)血流III级,血管C型以下夹层;
(5)术后30天内夹层出现率与夹层类(NHLBI分级,A~F);
(6)术后30天内穿孔出现率与严重程度;
(7)介入手术(包括辅助支架植入等)术后靶病变残余狭窄<50%的比率;
(8)即刻管腔获得(QCA方法测得的扩张前后靶病变最小管腔直径差值);
(9)术后30天内器械失效及故障;
(10)器械操作使用性能评价;
(11)术后30天内不良事件出现情况。
3.随访时间
随访时间一般至少需达到术后30天。
(五)样本量估算与统计研究举例
样本量估算需综合考虑临床试验设计、主要评价指标与统计学要求。申请人需弄清楚计算公式、相应参数及确定理由以及所用的统计软件。
按照基于单组设计时,目标值及预期值需按照临床指南、专家共识以及临床文献的Meta研究可靠确定。主要安全性评价指标若按照基于“术后14天内无MACE的比率”,主要有效性评价指标按照基于手术成功率(术后即刻残余狭窄率≤50%,且围术期无死亡、心肌梗死或靶病变血运重建)时,主要安全性指标目标值应不低于90%,主要有效性指标应不低于85%。一般情况下α=0.05,β=0.2。为保证临床试验样本与研究总体的匹配性,以及充分的统计学效能,建议临床试验样本量不低于200例。
样本量计算公式如下:
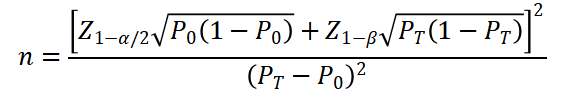
P为试验组预期事件出现率,P为目标值。
四、其他临床试验设计需关注的问题
因为修饰性球囊通过性较差,有时需要小一号直径的普通球囊先对病变开展预处理。若病变仍难以通过,可考虑用更大直径的普通球囊预处理,或者应用延长导管辅助器械通过。因此,针对狭窄严重的病变,在临床试验使用申报产品之前允许使用其他球囊先行扩张,以保证申报产品的可通过性,但为排除其对临床试验结果的影响,需严格记录先行使用球囊的类型、直径以及处理后管腔残余狭窄的情况,原则上处理后的管腔残余狭窄不宜低于50%。
考虑到冠脉支架在临床应用中的使用情况,临床试验主要有效性评价指标手术成功率可设定为“术后即刻残余狭窄率≤50%”。而临床实践中,药物球囊的要求更高且面临的弹性回缩问题更为显著。一般在充分预扩张后,同时满足以下三种情况,可以使用药物涂层球囊治疗:血管C型以下夹层;TIMI血流分级Ⅲ级;残余狭窄≤30%。因此,需在临床试验次要评价指标中通过了解“预处理后病变准备成功率,即预扩张后靶病变的管腔残余狭窄<30%;TIMI血流III级;血管C型以下夹层”,并在说明书临床试验概要中弄清楚该项指标的临床试验结果,供临床医师参考。
刻痕、棘突球囊产品的适用范围描述一般为“该产品用于成人患者经皮冠状动脉介入治疗中对血管狭窄病变开展预扩张处理”。若临床试验充分入组了轻度钙化病变患者,但中重度钙化病变患者入组较少,无法确认对中重度钙化的安全有效性,需在适用范围中弄清楚中重度钙化不适用。其他开口病变、分叉病变、CTO病变、支架内再狭窄、成角病变(成角>45)等的适用性在说明书中予以弄清楚。
切割球囊产品的适用范围描述一般为“该产品适用于成人患者经皮冠状动脉介入治疗中,对血管狭窄病变开展预扩张处理。同时靶病变斑块还需具备以下特征:病变长度≤20mm的局限性病变;参考血管直径为2.00mm-4.00mm;器械容易进入;近侧血管段弯曲度为轻度或中度;病变段非成角(<45);血管造影轮廓平滑”。仍然,若临床试验充分入组了轻度钙化病变患者,但中重度钙化病变患者入组较少,无法确认对中重度钙化的安全有效性,需在适用范围中弄清楚中重度钙化不适用。CTO病变、支架内再狭窄、开口病变、分叉病变成角病变(成角>45)等的适用性也需在说明书中予以弄清楚。
参考文献
[1]原国家食品药品监督管理总局.医疗器械临床试验设计指导原则:食品药品监管总局通告2018年第6号[Z].
[2]国家药品监督管理局.医疗器械临床评价技术指导原则:国家药品监督管理局通告2021年第73号[Z].
[3]国家卫生健康委. 国家卫生健康委办公厅关于印发冠状动脉球囊成形术与支架植入术操作规范(2022年版)与髋膝关节置换术操作规范(2022年版)的通知(国卫办医函〔2022〕77号) [EB/OL]. (2022-03-21) [2022-11-21]. http://www.nhc.gov.cn/yzygj/s7659/202203/d5cb0d71f5db461da0097c54b8296814.shtml.
[4]《药物涂层球囊临床应用中国专家共识(第二版)》专家组. 药物涂层球囊临床应用中国专家共识(第二版)[J]. 中国介入心脏病学杂志, 2023,6(31):413-426.
[5]中华医学会心血管病分会介入心脏病学组,中国医师协会心血管内科医师分会血栓防治专业委员会,中华心血管病杂志编辑委员会. 中国经皮冠状动脉介入治疗指南[J]. 中华心血管病杂志, 2016, 5(44): 382-400.
[6]中华医学会心血管病学分会. 冠状动脉生物可吸收支架临床应用中国专家共识[J]. 中华心血管病杂志,2020, 5(48): 350-358.
[7] 王伟民,霍勇,葛均波代表《冠状动脉钙化病变诊治中国专家共识》专家组. 冠状动脉钙化病变诊治中国专家共识. 中国介入心脏病学杂志, 2021,5(29): 251-259.
[8] 朱丹丹, 高婧, 夏慧琳等. 切割球囊系统在治疗冠状动脉血管疾病中的有效性与安全性研究[J]. 中国医学装备, 2022,4(19): 49-53.
[9] U.S. Food and Drug Administration. Premarket approval (PMA)-P050018 AngioSculpt® Evo RX PTCA scoring balloon catheter with hydrophilic coating[EB/OL]. (2021-12-23)[2022-11-21]. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P050018S030.
[10] U.S. Food and Drug Administration. Premarket approval (PMA)- p020037 FX minirail RX percutaneous transluminal coronary angioplasty (PTCA) catheter [EB/OL]. (2003-06-11) [2022-11-21]. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P020037.
[11] U.S. Food and Drug Administration. Premarket approval (PMA)- P200041 scoreflex NC scoring PTCA catheter [EB/OL]. (2021-12-21)[2022-11-21]. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P200041.
[12] U.S. Food and Drug Administration. Certain Percutaneous Transluminal Coronary Angioplasty (PTCA) Catheters - ClassⅡ SpecialControls Guidance for Industry and FDA[EB/OL].(2010-09-08)[2022-11-21]. https://www.fda.gov/medicaldevices/guidance-documents-medical-devices-and-radiationemitting-products/certain-percutaneous-transluminal-coronaryangioplasty-ptca-catheters-class-Ⅱ-special-controls.
| 附件二 《冠脉修饰球囊临床试验注册审查指导原则(部间征求意见稿)》反馈意见表 | ||||||||
| 序号 | 条款 | 原文内容 | 拟修改后内容 | 修改原因 | 修改依据 | 修改人、单位 | 手机号码 | 备注 |


 1408
1408

