本指导原则旨在指导注册申请人对幽门螺杆菌耐药基因检测试剂注册申报资料的准备及撰写,同时也为技术审评部门提供参考。

本指导原则是对幽门螺杆菌耐药基因检测试剂的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。
本指导原则是供注册申请人与技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。要是有能够满足相关法规要求的其他方法,也可以按照基于,然而需要提供详细的研究与验证资料。
本指导原则是在现行法规与标准体系以及当前认知水平下制定,随着法规与标准的不断改进,以及科学技术的不断发展,相关内容也将适时开展调整。
一、适用范围
本指导原则适用于按照基于实时荧光PCR法等分子生物学技术,对来自于人体的胃黏膜组织、粪便等样本中的幽门螺杆菌(Helicobacter pylori,Hp)耐药基因开展体外定性检测的试剂,临床主要用于幽门螺杆菌耐药的辅助诊断。
申报产品的适用人群应为幽门螺杆菌感染的确诊患者。幽门螺杆菌感染的确诊可以为尿素呼气试验(UBT)、已上市幽门螺杆菌核酸或抗原检测试剂、组织学检测等。
幽门螺杆菌不同基因与表型的耐药性之间符合率有较大差异,建议申请人选择公认符合率较高的抗生素耐药基因作为靶标,如克拉霉素耐药基因、左氧氟沙星耐药基因等。针对同一抗生素存在多个耐药基因或耐药突变位点的,申请人应考虑申报产品对耐药基因/位点的覆盖率。如针对同一抗生素的不同耐药基因位点的阳性结果对用药判断一致,申报产品可设计为不同基因单独检测,结果报告为具体突变类型;也可设计为不区分具体突变类型,结果报告为耐药/敏感。建议在产品预期用途中弄清楚,如:本产品用于体外定性检测来自幽门螺杆菌感染的确诊患者的xx样本中的yy耐药基因突变,可检测的突变类型包括xx基因zz突变,本产品可/不区分具体突变类型。针对耐药基因的表述,应满足临床通用的要求,如针对23S rRNA基因的A2142G、A2143G与A2142C点突变,针对gyrA 基因的A260T、C261A、T261G、G271A、G271T、A272G点突变等。
幽门螺杆菌耐药基因检测的产品不用于幽门螺杆菌感染的辅助诊断,此类产品不用于判断样本中幽门螺杆菌核酸的阴性或阳性。但在产品设计中,建议针对幽门螺杆菌保守核酸序列开展检测,检测结果作为幽门螺杆菌耐药基因检测的质控,只有当该质控阳性时才能开展后续耐药基因突变检测结果的判定。
对于按照基于其他方法学或者其他样本类型的幽门螺杆菌耐药基因检测试剂,可能部分要求不完全适用或本文所述内容不够全面,注册申请人应参照本指导原则,按照产品特性对适用部分开展评价,并补充其他的评价。
本指导原则适用于幽门螺杆菌耐药基因检测试剂开展产品注册与变更注册的情形。本指导原则针对注册申报资料中的部分内容开展撰写,其他未尽事宜应当符合《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告》等相关法规要求,同时建议参考《定性检测试剂研究性能评估注册审查指导原则》等适用的技术文件要求。
二、注册审查要点
(一)监管信息
1.产品名称及分类编码
产品名称应符合《体外诊断试剂注册与备案管理措施》及相关法规的要求,如幽门螺杆菌gyr A基因突变检测试剂盒(PCR荧光探针法)。按照《体外诊断试剂分类规则》,该产品按照第三类体外诊断试剂管理,分类编码为6840。
2.注册申请人还需提交产品列表、关联文件、申报前与监管机构的联系情况与沟通记录及符合性声明等文件。
(二)综述资料
综述资料主要包括概述、产品描述、预期用途、申报产品上市历史及其他需说明的内容。其中,需注意以下内容:
1. 弄清楚检测位点的临床意义,尤其是对于新突变位点,应提交支持检测位点临床意义的行业认可证据(如国内相关指南或专家共识)及支持性文献等,详述位点结果耐药机制、氨基酸突变位点(如适用)、基因型与表型耐药符合率,以及抗生素用药背景以及中国人群数据等。
2. 检验原理中详细说明产品所按照基于的技术原理及检测流程,弄清楚产品检测靶基因及靶序列,需选择保守性与特异性相对较高的基因与靶序列,同时还应考虑扩增效率。提供引物与探针的设计依据。提供核酸提取(手工与自动提取方式应分别弄清楚)及检测所用时间,提供不同适用机型的检测通量(如适用)。
3. 预期用途需弄清楚可检测靶基因、对应氨基酸突变(如有)及药物、样本类型、采样部位、适用人群等。
4. 与已上市同类与/或前代产品开展比较,比较内容包括方法学、检验原理、样本类型、采样部位及采样方式、检测靶基因、组成成分、内标、质控品、判读规则、预期用途、适用人群、研究性能与临床性能等方面。
(三)非临床资料
1.产品技术要求及检验报告
按照《医疗器械产品技术要求编写指导原则》的要求编写产品技术要求,性能指标一般包括阳性参考品符合率、阴性参考品符合率、最低检出限、精密度等,并提交三个不同批次符合产品技术要求的全项目检验报告。提交资料应符合《体外诊断试剂注册申报资料要求及说明》《医疗器械注册自检管理规定》等相关文件的要求。
2.研究性能研究
注册申请人应当在原材料与生产工艺经过选择与确认、质量管理体系得到有效控制并且保证产品质量稳定的基础上,按照基于完整、确定的检测系统开展研究性能评估。
对于每项研究性能的评价都应包括具体研究目的、研究方法、试验方案、试验数据、统计研究等详细资料。密切相关研究性能验证的背景信息也需在申报资料中有所体现,包括试验地点、按照基于的试剂名称、规格与批号,仪器名称与型号,样本类型与来源等。
研究性能评估所用样本的基本信息均需弄清楚,例如样本来源、样本类型、样本采集与处理方式、稀释方式等。研究中按照基于的幽门螺杆菌耐药基因突变阳性样本,应按照基于科学可靠的方法确定其突变类型、突变比例/浓度水平,并提交具体的试验资料。研究性能评估用样本一般应为真实样本(临床样本或培养菌株添加至阴性临床样本基质),不建议按照基于质粒等开展研究性能评估,如涉及稀释后检测,应按照基于与适用样本类型一致的阴性基质开展稀释。对于各项性能中按照基于的样本,在下述各项性能研究资料中分别提供样本信息列表。检出限与包容性研究中所用样本应相互独立。
针对适用的不仍然本类型分别开展研究性能研究。
如申报产品用于不同适用机型,应按照基于一个或多个机型,开展充分的试剂研究性能形成研究,对于其他机型,应研究各适用机型的工作原理、检测方法、反应条件控制、信号处理等,如基本一致,可基于风险研究对已形成的研究性能指标开展可靠验证。所有适用机型验证的研究性能应基本一致,如不同机型对某一检测项目的某一研究性能存在差异,应针对该差异按照基于不同机型开展充分的研究性能形成研究。
如试剂包括不同的包装规格,且不同规格间存在性能差异,需按照基于每个包装规格产品开展研究性能评估;如不同规格间不存在性能差异,需要详细说明各规格间的差别及可能产生的影响,按照基于具有代表性的包装规格开展研究性能评估。
建议着重对以下研究性能开展研究。
2.1样本稳定性
对样本稳定性开展详细研究,包括采集后未经处理的样本,不同的样本采集处理方法,加入不同裂解液/消化液/保存液的样本(如适用),研究内容包括冷藏保存时间,冷冻保存时间,冻融次数等。
如产品适用不同的样本类型,应对每种样本类型开展稳定性研究。
如核酸提取液可不立即开展检测,还需对核酸提取液的保存条件与保存时间开展研究。
2.2准确度
2.2.1建议按照基于申报试剂与已弄清楚型别与浓度样本或与已上市产品或其他比较方法同时检测临床样本比较耐药基因与内控基因检测结果之间的一致性程度。研究应纳入一定数量的阴性与阳性样本,并注意覆盖每种突变类型。
2.2.2企业参考品验证
按照主要原材料研究资料中的企业参考品设置情况,按照基于至少三批产品对企业参考品开展检验并提供详细的试验数据。
2.3精密度
精密度评价应对可能影响检测精密度的主要因素开展验证,除检测试剂(包括核酸提取/纯化组分)本身外,还包括仪器、操作者、时间、地点、检测轮次、试剂批次等,设计可靠的精密度评价周期,并对批内/批间、日内/日间、不同操作者间与不同实验室间的精密度开展综合评价。
针对所有待测突变位点开展精密度验证,并按照基于真实样本开展研究,同时至少按照基于3个浓度水平:
阴性样本:待测物浓度低于最低检测限,阴性检出率应为100%(n≥20)。
检出限水平样本:待测物浓度为检出限浓度,阳性检出率应相较而言更多95%(n≥20)。
中/强阳性样本:待测物浓度呈中度到强阳性,阳性检出率为100%,且Ct值的CV≤5%(n≥20)。
2.5检出限
检出限研究应针对所有待测突变位点开展评价。使用已弄清楚突变位点与浓度的培养菌株,按照基于与适用样本类型一致的阴性基质开展系列稀释,开展最低检测限的形成与验证。建议按照基于数字PCR、标准曲线(通过标准物质或构建质粒绘制标准曲线)等方法开展菌株核酸浓度/突变位点浓度的确认,以copies/mL作为表示方式。弄清楚每份菌株的来源、浓度、制备方法等信息。
2.5.1检出限的形成
对于此类产品,扩增反应终体系中的耐药突变序列所占百分率与总核酸浓度两个因素对最低检测限的影响较大,终体系中耐药突变序列所占百分率越高、所含的总DNA量越多,则越容易检出。因此,试剂盒最低检测限评价主要考虑以下两个方面。
100%耐药比例下,耐药菌株的最低检测浓度
将幽门螺杆菌耐药菌株用阴性基质开展系列稀释,制备不同浓度的耐药菌株样本。分别对各浓度样本开展不少于20次的重复检测,确定95%阳性检出率水平,作为可检测的最低耐药菌株浓度。
不同菌株浓度、各种耐药比例的最低检测限
将不同浓度野生菌株与耐药菌株开展混合,调整野生与耐药菌株的比例,得到含不同菌株浓度与各种耐药比例的菌株混合液。对各份混合液开展不少于20次的重复检测,确定95%阳性检出率水平下的浓度水平,即在固定的核酸浓度条件下,可以检测到的最低的突变序列百分率。
2.5.2检出限的验证
针对每种突变类型选择不同于形成用临床样本,在已形成的检出限水平开展至少20次的重复检测,应满足95%以上检出率要求。
2.6包容性
按照试剂盒检测范围选择具有时间与区域特征性的不同来源的临床样本或培养菌株。每种突变位点不少于5例样本,研究应包括检出限与重复性的验证。
2.7研究特异性
2.7.1交叉反应
2.7.1.1常见病原体交叉反应
交叉反应验证的病原体种类主要考虑以下几方面:近缘菌、易引起一致或相似的临床症状微生物、感染部位附近的定植菌等。粪便样本建议考虑空肠弯曲菌、梭状芽胞杆菌属 、埃希菌属、肠杆菌属、肠球菌属、变形杆菌属、人感染其他螺杆菌 (如:海尔曼螺杆菌、鼠螺杆菌、猪螺杆菌等);胃黏膜组织建议考虑空肠弯曲菌、变形杆菌属、链球菌属、葡萄球菌属、双歧杆菌属、乳酸菌属、人感染其他螺杆菌 (如:海尔曼螺杆菌、鼠螺杆菌、猪螺杆菌等)。
建议在病毒与细菌感染的医学相关水平开展交叉反应的验证。通常,细菌感染的水平为10 CFU/mL或更高,病毒为10PFU/mL或更高。
申请人应提供所具有作用于交叉反应验证的微生物的来源、种属/型别与浓度确认等试验资料。
2.7.1.2申报产品包括的不同耐药突变位点之间的交叉反应、申报产不包括的其它幽门螺杆菌耐药基因突变的交叉反应。
2.7.1.3其他耐药细菌交叉:建议纳入具有申报产品耐药表型的其他细菌的交叉研究,如耐左氧氟沙星金黄色葡萄球菌等。
在交叉反应研究中,申请人除关注对耐药基因检测结果的影响,还应关注内控基因的检出变化。
2.7.2干扰研究
按照所采集样本类型,针对可能存在的内源/外源物质干扰情况开展验证。建议申请人在每种干扰物质的潜在最大浓度(“最差条件”)条件下开展试验,检测至少包括临界阳性水平在内的幽门螺杆菌样本。对结果开展可靠的统计研究,比较添加干扰物质前后的 Ct 值差异。检测的潜在干扰物包括样本中的原有物质及在样本采集与处理期间引入的物质。
2.7.2.1内源性干扰
粪便样本:白细胞、血红蛋白、脂肪、肠道分泌物或粘液 、膳食纤维、多糖等。
胃黏膜组织:血液、粘蛋白、白细胞、胆汁、胃液、胃蛋白酶等。
2.7.2.2外源性干扰
抗菌药物:克拉霉素、左氧氟沙星、阿莫西林、四环素、甲硝唑、呋喃唑酮等。
其他常见治疗药物:质子泵抑制(如奥美拉唑、艾司奥美拉唑、雷贝拉唑、兰索拉唑、泮托拉唑、艾普拉唑等)、铋剂(如枸橼酸铋、胶体果胶铋、次水杨酸铋等)、钾离子竞争性酸阻滞剂(如伏诺拉升、替戈拉生、凯普拉生等)、痔疮膏、通便灵、铝碳酸镁、乳酸菌素与中成药、促胃肠动力药(多潘立酮、莫沙必利等)、消化酶等。
益生菌:乳杆菌、双歧杆菌、丁酸梭菌、枯草二联杆菌,地衣芽孢杆菌等。
胃黏膜组织样本采集与处理期间引入的物质(如去泡剂:二甲硅油、西甲硅油等)。
2.7.2.3竞争性干扰
临床上存在多种耐药基因突变的情况,应考虑评价高浓度研究物对低浓度研究物检测的影响。竞争性感染的突变位点组合建议考虑同一反应体系内常见不同耐药突变位点混合存在的情形,考察高浓度/高突变比例位点对低浓度/低突变位点检测的影响。
2.8核酸提取/纯化性能
核酸提取/纯化步骤的目的除最大量分离出目标DNA外,还有相应的纯化作用,应尽可能去除PCR抑制物。粪便样本类型对PCR抑制物的去除要求较高,在核酸提取试剂的选择中应关注。
研究确定核酸提取方法,阐述核酸提取原理,提交提取方案选择研究资料。无论申报产品是否含有DNA分离/纯化的组分,注册申请人都应对配合使用的所有核酸提取试剂开展提取核酸纯度、浓度、提取效率的研究。若产品适用可归结成两种或以上核酸提取试剂,则每一种核酸提取试剂均需配合检测试剂开展抗干扰、再现性与检出限的验证。要是配套核酸提取试剂提取原理存在差异,还需额外开展检出限的形成研究。
2.10反应体系
2.10.1样本采集与处理
2.10.1.1详述样本采集部位、采集方式、样本采集量的选择,提供相关的研究资料。包括对样本的收集、制备或处理、运输(如涉及)与储存的方式开展验证,必要时开展选择与确认并提供相关的研究资料。不同类型的样本应分别开展研究。参考布里斯托(Bristol)大便分类法,粪便样本建议关注对不同类型粪便的研究,如有不适合样本(如水样便)应在说明书弄清楚。胃黏膜组织样本建议关注采样位点位置(如幽门胃窦/胃体)、数量等。
2.10.1.2样本采集时间点的选择:是否受病程、临床症状、用药情况、用药间隔等因素的影响。
2.10.1.3样本处理方式的选择:研究样本适用的保存与处理方式,包括样本用量、粪便沉淀/离心处理、组织研磨、蛋白酶消解等。
2.10.2核酸提取与反应体系
研究确定最佳核酸提取与反应体系,包括核酸提取用的样本体积、洗脱体积、PCR反应加样体积及反应各阶段温度、时间、循环数等。
提交不同适用机型基线与阈值循环数的确定资料。
不同适用机型的反应条件要是有差异应分别详述,并提交验证资料。
3.稳定性研究资料
申报试剂的稳定性主要包括实时稳定性、运输稳定性、使用稳定性等研究,申请人可按照实际需要选择可靠的稳定性研究方案。稳定性研究资料应包括研究方法的确定依据、具体的实施方案、详细的研究数据以及结论。对于实时稳定性研究,应提供至少三批样品在实际储存条件下保存至成品有效期后的研究资料。对于开瓶稳定性研究应模拟真实使用情形,包括开瓶稳定性的开瓶频次与开瓶时间等。
4.阳性判断值研究资料
阳性判断值研究样本来源应为预期人群,并考虑不同性别、年龄、地域等因素,尽可能考虑样本来源的多样性、代表性,尽量纳入较多弱阳性的样本,以及一定数量的其他容易产生交叉反应的样本。申报产品如区分突变类型,应对不同突变位点应分别开展统计研究。建议申请人按照基于受试者工作特征(ROC)曲线的方式确定申报试剂阳性判断值,亦可按照基于其他科学可靠的方法开展研究。如判定值存在灰区,应提供灰区的确认资料。如产品设计了内控基因用于质控幽门螺杆菌感染,也应提交内控基因阳性判断值研究。
提交阳性判断值形成及验证研究资料时,应包括研究方案、设定评价标准、研究过程以及研究原始数据等。其中所用样本的背景信息列表,至少包括性别、年龄、样本类型、临床诊断信息、样本来源机构、检测结果等信息。
要是产品适用不仍然本类型,应对各样本类型开展阳性判断值的验证。
提供内标检测结果范围的确定方法与研究资料。
5.其他资料
5.1主要原材料研究资料
此类产品的主要原材料包括引物、探针、酶、dNTP、核酸分离/纯化组分(如有)、企业参考品、质控品等。应提供主要原材料的来源与选择、制备过程、质量控制标准等相关研究资料、质控品的定值试验资料等。如主要原材料为企业自制,应提供其详细的制备、鉴定与质量控制过程,制备工艺应相对稳定;如主要原材料源于外购,应提供资料包括:选择该原材料的依据及比较筛选试验资料、质量标准、出厂检验报告,以及该原材料到货后的入厂检验报告。生产商应固定,不得随意更换。
5.1.1引物与探针
应详述引物与探针的设计原则,包括对包容性与特异性的考虑情况,提供引物、探针核酸序列、靶序列的基因位点及两者的对应情况。产品的内控基因的引物探针建议针对幽门螺杆菌保守核酸序列设计。建议设计两套或多套引物、探针以供筛选,通过序列比对与功能性试验等方式,对产品检出限、包容性与特异性开展评价。通过筛选确定最佳的引物与探针组合。引物、探针的质量标准应至少包括序列准确性、纯度、浓度、探针标记的荧光素及功能性试验等。
5.1.2脱氧三磷酸核苷(dNTPs)
包括dATP、dCTP、dGTP、dTTP或dUTP,应提交对其纯度、浓度、功能性试验等的验证资料,并确定质量标准。
5.1.4酶
需要的酶主要包括DNA聚合酶、尿嘧啶DNA糖基化酶(如有)等,应分别对酶活性、热稳定性、功能性等开展评价与验证。
5.1.4质控品
试剂盒一般包括阴性质控品与阳性质控品。阳性质控品应包括试剂盒检测的靶序列,可按照基于质粒等制备。如产品设置应用于阳性判断值判断的野生型阳性质控品,应考虑靶标序列的完整性。质控品需参与样本处理、核酸的平行提取与检测的全过程,以对整个提取与PCR扩增过程、试剂/设备、交叉污染等环节开展可靠质量控制。提交试剂盒质控品密切相关原料选择、制备、定值过程、浓度范围等试验资料,对质控品的检测结果Ct值范围做出弄清楚的要求。
5.1.5内标
内标,又称内对照,可对管内抑制结果的假阴性结果开展质量控制,应与靶核酸一同提取及扩增。申请人需对内标的引物、探针设计与相关反应体系的浓度做精确验证,既要保证内标荧光通道呈显著的阳性曲线又要尽量减少对靶基因检测造成的抑制。弄清楚内标的检测结果Ct值范围。建议科学设置内标,对待测样本的取样质量、试剂的反应体系开展监控。
5.1.6企业参考品
该类产品的企业参考品一般包括阳性参考品、阴性参考品、检出限参考品与精密度参考品。应按照产品性能验证的实际需要设置企业参考品。
应提交企业参考品的原料来源、选择、制备、耐药位点及突变比例、浓度确认方法或试剂等相关验证资料。企业参考品应按照基于临床样本,或者使用培养菌株加入阴性基质。企业参考品的设置建议如下:
阳性参考品:应设置不同的浓度水平,并应包括申报产品声称可检测的突变位点。
阴性参考品:主要涉及对交叉反应的验证情况,纳入阴性临床样本、野生型幽门螺杆菌、空肠弯曲菌、检测范围外的其他耐药突变位点。
检出限参考品:可按照基于95%阳性检出水平或略高于检出限的水平(应弄清楚幽门螺杆菌核酸浓度与耐药突变比例)。包括所有的耐药突变位点,可按照基于待测幽门螺杆菌耐药基因突变阳性培养菌株与野生幽门螺杆菌培养菌株开展适当的配制。
精密度参考品:精密度参考品应包括申报产品声称的主要耐药突变位点,试剂盒包括不同反应体系时,精密度参考品应至少包括每个反应体系的代表性位点。至少包括弱阳性(低浓度突变)水平。
5.2生产工艺研究资料
生产工艺研究资料主要包括工作液配制(引物、探针浓度、酶浓度、dNTP浓度、缓冲液离子浓度等)、分装与冻干(如有)、荧光标记等工艺过程的描述及确定依据。生产过程应对根本参数开展有效控制,可按照基于流程图方式描述生产工艺,标注清楚根本工艺质控步骤,并详细说明该步骤的质控方法及质控标准。提交主要生产工艺的确定及优化研究资料。
2.临床试验方法
2.1与比较方法的比较研究
2.1.1对于已有同类产品上市的,临床试验应选择已上市的同类产品作为比较试剂,评价申报产品与已上市同类产品的一致性,评价内容应包括耐药基因及位点的检测与相关内控基因的检测。比较试剂的选择应考虑检测的耐药基因及突变位点范围、适用的样本类型、产品性能等方面应与试验体外诊断试剂具有良好的可比性,选择已上市同类产品开展临床试验时,比较试剂配套使用的核酸提取试剂应满足其说明书要求。
比较方法建议选择能够区分不同基因及不同突变位点的产品。如临床试验选择不区分突变位点的产品作为比较产品,临床试验还应针对比较方法检测阳性病例按照基于合适的方法确认突变类型。
2.1.2对于尚无同类产品上市的,申请人可按照基于试验体外诊断试剂与核酸序列测定(如Sanger测序等)方法开展比较试验,评价可归结成两种检测方法的一致性,评价内容应包括耐药基因及位点的检测与相关内控基因的检测。
临床试验资料中应对测序方法开展详细的介绍,针对测序过程的引物设计应提供依据。弄清楚检测过程中配套使用的核酸提取试剂,针对测序方法提交性能验证数据,证明测序方法与试验体外诊断试剂的可比性。如测序试验委托其他机构完成,还应提交由临床试验机构委托第三方机构/实验室开展相关试验的测序服务合同/协议。
2.2与药敏试验的比较研究
在上述比较研究的基础上,因为进一步评价产品临床性能,临床试验还应按照基于试验用体外诊断试剂与幽门螺杆菌体外药敏试验(如E-test试验等)开展比较研究。临床试验过程中选择的微生物药敏检测试剂抗生素应与产品说明书预期用途中弄清楚的抗生素一致。
3.临床试验受试人群的选择
临床试验的受试人群应来自产品的预期适用人群,基于产品预期用途,临床试验入组人群应为已确诊为幽门螺杆菌感染的病例。幽门螺杆菌感染的确诊可以为尿素呼气试验(UBT)、已上市幽门螺杆菌核酸或抗原检测试剂、组织学检测等。
针对2.1与比较方法的比较研究(耐药基因检测与已上市同类产品与/或核酸序列测定方法的比对研究),因入组病例在治疗前及治疗后病原体载量及耐药情况可能存在差异,因为充分评价产品性能,建议临床试验针对治疗前与治疗后的病例均有一定数量的入组。
针对该类产品特点,产品在设计过程中包括内控基因。因为进一步评价内控基因的性能,临床试验需开展内控基因与已上市同类产品或核酸序列测定方法的比对,该部分研究入组人群应为疑似幽门螺杆菌感染的病例。
临床试验应针对耐药基因入组一定数量的弱阳性病例。
4.临床试验样本类型
幽门螺杆菌耐药基因检测可能涉及的样本类型包括胃粘膜组织、粪便等。临床样本的采集建议按照国家卫健委发布的相关实验室检测技术方案执行。对于胃黏膜组织,如临床前性能研究确认新鲜胃黏膜组织与冻存胃黏膜组织之间不存在差异,则临床试验可以汇总统计或以其中一种开展。
如申报产品适用于不同的样本类型,例如胃粘膜组织、粪便等,应针对不仍然本类型分别开展临床性能评价,包括分别开展样本量的估算等。
5.临床试验样本量
建议按照基于单组目标值法公式开展样本量估算,临床试验阳性样本与阴性样本数量应分别满足统计学要求。
5.1针对与已上市同类产品或核酸序列测定方法的比较试验,可按照基于单组目标值法公式分别估算每个抗生素耐药基因的最低阳性与阴性样本例数。
样本量估算公式如下,
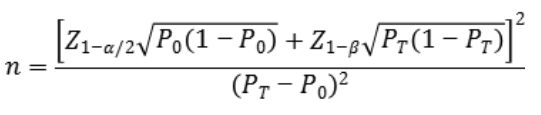
公式中,n为样本量;Z、Z为显著性水平与驾驭度的标准正态分布的分数位,P为评价指标的临床可接受标准,P为申报产品评价指标预期值。
其中阳性符合率与阴性符合率的临床可接受标准(P)建议不低于90%。临床试验结果中,相关评价指标的95%置信区间下限应不低于预设的临床可接受标准。当评价指标P接近100%时,上述样本量估算方法可能不适用,应考虑选择更加适宜的方法开展样本量估算与统计学研究,如精确概率法等。
临床试验中,针对产品检测范围内的每种突变位点均应具有一定的阳性例数。针对临床常见的各突变位点分别不低于70例。针对临床试验过程中较难收集的突变位点,病例数不少于30例。
5.2针对与药敏试验的比较试验,可按照基于单组目标值法公式分别估算每个抗生素的最低耐药与敏感样本例数。其中灵敏度与特异度的临床可接受标准(P)的设置应满足临床使用需求。
5.3针对内控基因与已上市同类产品或核酸序列测定方法的比较试验,可按照基于单组目标值法公式分别估算最低阳性与阴性样本例数。其中阳性符合率与阴性符合率的临床可接受标准(P)的设置应满足临床使用需求。
6.临床试验结果的统计研究
临床试验结果一般以四格表的形式开展总结,并据此计算试验体外诊断试剂的灵敏度与特异度,或与比较方法的阳性/阴性符合率及其95%置信区间。
临床试验报告中应对入组受试者的基本情况开展研究,包括受试者年龄、性别的分布情况,以及临床诊断背景、既往治疗情况等。特别应针对用于特异性评价的各类受试者开展归类汇总,确认入组样本具有较好的代表性。临床试验中如涉及不仍然本类型,应针对每种样本类型分别开展统计研究。
临床试验应针对经治疗及未经治疗的病例开展亚组研究,产在两个亚组中的性能应满足临床要求。
临床试验中所有纷歧致结果均应结合患者的临床症状、临床诊断以及疾病治疗、转归等信息开展充分的研究。临床试验结果应能够证明产品临床性能满足临床要求。
7.境外临床试验数据的认可
境外临床试验数据应符合《接受医疗器械境外临床试验数据技术指导原则》与《使用体外诊断试剂境外临床试验数据的注册审查指导原则》的相关要求。提交完整的临床试验方案、报告与伦理审查意见,以及该数据适用于中国患者人群的论证资料、境内外临床试验质量管理差异的比较资料与临床试验质量管理差异对于临床试验结果影响的论证资料。
注册申请人应按照上述临床试验技术审评要求,论证境外临床试验数据的充分性。
8.临床证据的形式要求
申请人应按照《体外诊断试剂注册与备案管理措施》、《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告》等法规文件要求提交各机构伦理审查意见、临床试验方案、临床试验小结、临床试验报告以及临床试验数据库。
临床试验数据汇总表中应提供病例的临床诊断结果及支持病例临床诊断结果的信息。
(五)产品说明书与标签样稿
产品说明书格式应符合《体外诊断试剂说明书编写指导原则》的要求。产品说明书中技术内容均应与注册申报资料中的相关研究结果保持一致,如某些内容引用自参考文献,应以规范格式开展标注,并单独列明文献的相关信息。
幽门螺杆菌耐药基因突变检测试剂说明书编写应重点关注以下内容。
1.【预期用途】
1.1试剂盒用于体外定性检测已确诊为幽门螺杆菌感染的患者XX样本中的yy耐药基因突变,可检测的突变类型包括xx基因zz突变,本产品可/不区分具体突变类型。
1.2 试剂盒用于XXX(抗生素)耐药的临床辅助诊断,为临床医生评估个体中幽门螺杆菌的耐药性提供参考。
1.3适用人群:已确诊为幽门螺杆菌感染的患者。
1.4简要介绍幽门螺杆菌耐药基因突变位点的特征,包括突变位点的描述,所检测的耐药突变位点与相应药物的相关性。
1.5强调该试剂盒检测结果仅供临床参考,不应作为治疗药物调整的唯一依据,临床医生应结合患者病情及其他实验室检测指标等因素对患者治疗开展综合判断。
2.【检验原理】
简述核酸提取纯化及试剂盒检测原理,说明检测的耐药突变位点信息,弄清楚内标基因名称及其作用。如按照基于了防污染措施,开展简要描述。如可开展幽门螺杆菌阴阳性判定,应对其原理简要描述。
3.【主要组成成分】
弄清楚试剂盒中各组分及具体成分,弄清楚需要但未提供的材料,如核酸提取试剂、样本保存液及其他配套使用的材料的产品名称、生产厂家、货号及注册证号或备案号等信息。
4.【样本要求】
弄清楚样本采集时间点的选择,是否受临床症状、用药情况、用药间隔等因素的影响等。
详细描述样本采集、保存、运输与处理方式,包括采样步骤,采样量,保存液使用体积等。如有临床公认推荐的采样要求,应遵循,并引用相应的技术规范或指南。描述样本及核酸提取液的保存稳定性。
5.【检验方法】
弄清楚核酸提取用的样本体积、洗脱体积与PCR加样体积,阴阳性质控品与待测样本同步开展核酸提取操作。弄清楚各适用机型的反应参数设置,基线、循环阈值(Ct值)的选择方法,以及各检测靶标对应的荧光通道。弄清楚内标、质控的检测结果Ct值范围。
6.【阳性判断值】
简述阳性判断值确定的方法,包括研究人群特征、研究样本量与统计研究方法等。
7.【检验结果的解释】
通过扩增曲线与Ct值开展结果阴阳性的判断,列明结果阴性、阳性、灰区、复测、无效等所有情形。
8.【检验方法局限性】
8.1本试剂检测结果应结合患者临床症状及其他相关医学检查结果开展综合研究,不得单独作为患者管理的依据。
8.2 本产品仅检测靶标区域内突变引起的耐药。由其他基因或基因区域的突变、以及其他耐药机制引起的耐药本产品不能检出。
8.3结果假阴性/假阳性结果的概率研究:
8.3.1不可靠的样本采集、处理、运输及保存条件,样本中目标物浓度过低。
8.3.2 待测目标基因序列的变异或其他原因结果的序列改变。
8.3.3耐药基因型与表型存在一定的纷歧致性。
8.3.4未经验证的其他干扰,如内源性或外源引入样本的物质。
8.3.5是否受用药影响,弄清楚与根除治疗或其他经验用药的时间间隔。
9.【产品性能指标】详述以下性能指标:
简述试剂性能指标与研究情况,建议包括:参考品的符合性、准确性、检出限、包容性、精密度、研究特异性、临床试验等。
10.【注意事项】应至少包括以下内容:
10.1试剂保存运输及使用过程中多种因素可能结果性能变化,如保存运输不当、样本采集、样本处理及检测过程操作不规范等,请严格按照说明书操作。
10.2生物安全防护相关内容
10.3避免实验室污染的措施
三、参考文献
[1] 国家药品监督管理局. 关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告: 国家药品监督管理局公告2021年第122号[Z].
[2] 国家药品监督管理局医疗器械技术审评中心.体外诊断试剂说明书编写指导原则(2023年修订版): 国家药品监督管理局医疗器械技术审评中心公告2024年第1号[Z].
[3] 国家药品监督管理局医疗器械技术审评中心.定性检测试剂研究性能评估注册审查指导原则: 国家药品监督管理局医疗器械技术审评中心公告2022年第36号[Z].
[4]中华医学会消化病学分会幽门螺杆菌学组. 2022中国幽门螺杆菌感染治疗指南[J].中华消化杂志,2022,42(11):745-756.
[5] Malfertheiner P, Megraud F, Rokkas T, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022; 71:1724–1762.
[6] 中华医学会肿瘤学分会早诊早治学组. 胃癌早诊早治中国专家共识(2023版)[J]. 中华消化外科杂志, 2024, 23(1): 23-36.



 1408
1408

