
本指导原则旨在指导注册申请人对人KRAS(kirsten rat sarcoma viral oncogene)基因突变检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审查提供参考。
本指导原则是对该类试剂注册申报资料的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。如注册申请人认为有必要增加本指导原则不包括的研究内容,可自行补充。
本指导原则是供注册申请人与技术审评人员使用的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,要是有能够满足相关法规要求的其他方法,也可以按照基于,但需要提供详细的研究资料与验证资料。需在遵循相关法规与强制性标准的前提下使用本指导原则。
本指导原则是在现行法规、标准体系以及当前认知水平下制定的,随着法规、标准的不断改进与科学技术的不断发展,本指导原则相关内容也将适时开展调整。
一、适用范围
本指导原则适用于按照基于核酸聚合酶链式反应(PCR法),对10%中性缓冲福尔马林固定石蜡包埋(FFPE)组织样本中的KRAS基因突变状态开展体外定性检测的试剂。本指导原则以用于结直肠癌(CRC)患者的西妥昔单抗(Cetuximab) 伴随诊断的预期用途为例,阐述基于PCR法的KRAS基因突变检测伴随诊断试剂临床前及临床研究相关要求,对于声称其他伴随诊断药物、癌种及方法学的KRAS基因突变检测试剂,申请人可参照本指导原则相关要求,按照产品特性对适用部分开展评价,并补充其他的评价资料。
KRAS是一种鼠类肉瘤病毒癌基因,由RAS家族成员基因编码的一种GTP酶蛋白,参与表皮生长因子受体(epidermal growth factor receptor,EGFR)的信号转导,调控细胞生长、分化、增殖与存活。人KRAS基因突变可影响基因的正常功能,引起细胞生长、分化失去控制,最终结果肿瘤的形成。结果KRAS处于激活状态的突变主要位于基因2外显子(第12、13位密码子)、3号外显子(第59、61位密码子)、4号外显子(第117、146位密码子)号上,包括多种突变类型。KRAS基因突变使癌症患者对抗EGFR抗体类药物产生耐药,进而不能从该类药物治疗中获益,而KRAS基因野生型患者则可以从这类药物中显著获益。KRAS作为结直肠癌治疗的分子靶标受到普遍关注,并已陆续开发出了西妥昔单抗等抗EGFR抗体类药物。
针对用于结直肠癌(Colorectal Cancer,CRC)患者的西妥昔单抗的伴随诊断试剂,所覆盖的突变位点应按照其不同突变位点的突变率设置,建议至少包括第2号外显子的第12号与13号密码子的7种热点突变,包括G12D 、G12C、G12S、G12R、G12V、G12A、G13D。
本指导原则适用于人KRAS基因突变检测试剂注册申请与变更注册申请的情形。本指导原则针对人KRAS基因突变检测注册申报资料中的部分内容开展撰写,其他未尽事宜应当符合《关于公布体外诊断试剂注册申报资料要求与批准证明文件格式的公告》等相关法规要求。
二、注册审查要点
(一)监管信息
1.产品名称及分类编码
产品名称应符合《体外诊断试剂注册与备案管理措施》及相关法规的要求,如人KRAS基因突变检测试剂(PCR法)。按照《体外诊断试剂分类目录》,与治疗药物靶点检测相关的试剂与伴随诊断用试剂,按照第三类体外诊断试剂管理,分类编码为6840。
2.其他信息
还包括产品列表、关联文件、申报前与监管机构的联系情况与沟通记录以及符合性声明等文件。
(二)综述资料
综述资料主要包括概述、产品描述、预期用途、申报产品上市历史及其他需说明的内容。其中,与同类与/或前代产品的比较应着重从技术原理、主要组成成分、被测靶标(基因突变位点)、预期用途、性能指标、临床应用情况等方面详细说明申报产品与已获批准的同类与/或前代产品之间的主要区别。预期用途应详述KRAS基因突变与适应症之间的关联,药物对不同KRAS突变类型的患者治疗效果描述,提交相应支持性资料。
(三)非临床资料
1.产品技术要求及检验报告
注册申请人应当在原材料质量与生产工艺稳定的前提下,按照产品研制、前期评价等结果,依据国家标准、行业标准及密切相关文献资料,结合产品特性按照《医疗器械产品技术要求编写指导原则》的要求编写。该类产品作为第三类体外诊断试剂,应当以附录形式弄清楚主要原材料以及生产工艺要求。
人KRAS基因突变检测试剂已有适用的国家参考品,技术要求中应体现国家参考品的相关要求,并使用国家参考品对三批产品开展检验。
如有适用的国家标准、行业标准,产品技术要求的相关要求应不低于相应的要求。
2. 研究性能研究
注册申请人应按照基于在符合质量管理体系的环境下生产的试剂盒开展所有研究性能研究,提交具体研究方法、试验方案、试验数据、统计研究等详细资料。
如申报产品适用不同的机型,需要提交按照基于不同机型开展性能评估的资料。如申报产品包括不同的包装规格,需要对各包装规格开展研究或验证。
研究性能评估所用样本的基本信息均需弄清楚,例如样本来源、类型、数量、采集与处理方式、稀释方式等。研究中按照基于的人KRAS基因突变FFPE样本,应按照基于科学可靠的方法确定其突变类型、突变序列百分率与人基因组DNA浓度水平,提交具体的试验资料。如涉及样本稀释后检测,应按照基于与适用样本类型一致的阴性基质。对于各项性能中按照基于的样本,在下述各项性能研究资料中分别提供样本信息列表。
2.1样本稳定性
2.1.1样本提取前核酸序列的稳定性
对于经福尔马林固定石蜡包埋的组织样本,通常较为稳定。申请人可依据相关专家共识及文献,确定样本的保存温度及保存年限。一般而言,样本保存年限不宜超过3年,以确保样本质量及后续试验的可靠性。
2.1.2样本提取后核酸序列的稳定性
应检测样本提取后核酸的含量,设置反应体系所需初始DNA含量范围,如单位体积DNA浓度超过所需浓度上限或下限,应提供相应的改进措施。可按照基于紫外-可见分光光度计对DNA浓度开展定量,通过260 nm/280 nm处的吸光度比值(OD260/OD280)或其他方法评价其纯度。同时,应对核酸提取物的保存时间、保存温度开展验证。并评价冻融次数、储存条件等对样本提取后核酸序列稳定性的影响。
2.2 适用的样本类型
列明产品适用的样本类型为CRC FFPE病理组织样本。
2.3准确度
按照基于申报试剂与测序结果或已上市同类产品,同时检测临床样本,比较检测结果之间的一致性程度,开展申报试剂的准确度评价。
研究用样本应纳入一定数量的人KRAS基因突变型CRC FFPE临床样本与野生型CRC FFPE临床样本,并注意覆盖产品检测范围内的每种突变类型样本,并且应包括不同肿瘤分期(I-IV期)样本、不同组织分型样本、不同肿瘤组织含量样本及干扰样本。
2.4企业参考品验证
按照主要原材料研究资料中的企业参考品设置情况,按照基于三批产品对企业参考品开展检验并提供详细的试验数据。
2.5精密度
精密度评价应对可能影响检测精密度的主要因素开展验证,除检测试剂(包括核酸提取/纯化组分)本身外,还应包括仪器、操作者、时间、地点、检测轮次、试剂批次等,设计可靠的精密度评价周期,并对批内/批间、日内/日间、不同操作者间与不同实验室间的精密度开展综合评价。
评价用样本应为涵盖产品检测范围内所有基因突变类型的FFPE临床样本,对于G12R、G12C等罕见基因突变类型,可按照基于FFPE细胞系、含有靶序列的核酸或质粒与人KRAS野生型CRC FFPE临床样本制备DNA存储液开展精密度研究。试验操作应按照说明书执行,需包括核酸提取/纯化等样本处理步骤。样本应至少包括3个水平:阴性样本、检出限水平样本、中/强阳性样本,并按照产品特性设定适当的精密度要求,例如:
阴性样本:应包括人KRAS野生型样本,阴性符合率应为100%(n≥20)。
检出限水平样本:阳性符合率应≥95%(n≥20)。
中/强阳性样本:反应体系中人基因组DNA浓度水平呈中度到强阳性,且突变序列百分率呈中到高百分比,阳性检出率为100%且CV≤5%(n≥20)。
2.6检出限
研究应包括扩增反应终体系中的突变序列百分率与申报产品反应体系中人基因组DNA浓度两个因素。
2.6.1检出限的形成
形成研究的样本应包括涵盖产品检测检测范围内所有基因突变类型的FFPE临床样本,对于G12R、G12C等罕见基因突变类型,可按照基于FFPE细胞系、含有靶序列的核酸或质粒与人KRAS野生型CRC FFPE临床样本制备DNA存储液。
研究应按照基于不同突变百分率及不同梯度浓度人基因组DNA样本开展多次重复检测,将95%检出率水平的突变百分率及人基因组DNA浓度,确定为产品检出限。
KRAS基因不同突变百分率样本混合应注意,每种突变类型样本储存液按照不同突变序列所占比例开展混合,应至少包括目标检出限与检出限上下至少各2个梯度比例范围。对于按不同比例混合后的样本,建议按照基于可靠的方法验证各样本的实际混合比例。同时,在KRAS基因突变不同比例研究过程中应设置KRAS野生型样本作为空白对照。
不同人基因组DNA量样本混合稀释应注意,使用的FFPE样本应与待混合配置样本类型一致。建议申请人设计一个显著高于反应体系最高DNA加样量的DNA浓度,在实际的KRAS不同突变比例下,开展不同梯度DNA浓度的检测。不同梯度DNA浓度范围应涵盖申报产品反应体系中设定的最高DNA浓度与最低DNA浓度。
2.6.2检出限的验证
针对每种突变类型选择不同于形成用临床样本,在已形成的检出限水平开展验证,建议对最低检出限与检测上限附近水平的样本开展至少20次的重复检测,应满足95%以上检出率要求。
2.7研究特异性
2.7.1交叉反应
该类产品主要与结直肠部位肿瘤存在较强关联性,申请人在设计交叉反应研究时应将此点纳入考虑。
申请人应考虑与靶序列的核酸序列相近或具有同源性、易引起交叉反应的野生型或其他突变类型序列的交叉反应。建议交叉反应验证考虑以下因素:KRAS基因不同序列;RAS家族不同基因等;高浓度野生型人DNA样本、非人类基因组基因、产品检测范围内各突变位点间的交叉干扰等。
非人类基因组基因样本应包括可能产生交叉反应的常见肠道感染病原体、CRC组织获取时易感染病原体等,如艰难梭菌、志贺氏菌、弯曲杆菌、耶尔森氏菌、沙门氏菌、大肠埃希氏菌、金黄色葡萄球菌等,需在有临床意义相关浓度下开展检测,细菌浓度水平建议至少10 cfu/mL,病毒浓度水平建议至少10 pfu/mL。
试验方案需弄清楚用于交叉反应验证的样本来源、制备方法、核酸序列确认与浓度选择等,并提交详细的研究资料。
2.7.2干扰研究
应针对可能的内源与外源性干扰物开展干扰试验研究。对于FFPE样本,内源性干扰物质应包括血红蛋白、甘油三酯、坏死组织等,外源性干扰物质应包括福尔马林、石蜡、二甲苯、乙醇、蛋白酶K、常用治疗药物等。
干扰试验可通过在所有突变类型检出限水平处DNA存储液中加入干扰物质的方式,评价干扰物质对目标基因检测的影响,也可直接按照基于暴露于干扰因素后的受试者样本,开展干扰试验评价。建议申请人在每种干扰物质的潜在最大浓度(“最差条件”)条件下开展评价;如有干扰,应确定不产生干扰的最高浓度。
2.8核酸提取/纯化性能
石蜡包埋组织样本在福尔马林固定过程中,会使样品中的核酸与核酸之间、核酸与蛋白之间出现交联。因此,在开展核酸检测之前,应有核酸提取/纯化步骤。该步骤的目的除最大量分离出目的核酸外,还有尽可能去除PCR抑制物的纯化作用。申请人需设置可靠的评价方案(如:对同一CRC FFPE临床样本中段部分开展多份连续切片,等)与评价指标,评价样本核酸提取过程的重复性。
无论检测试剂是否含有核酸提取/纯化的组分,企业都应结合检测试剂的特性,对配合使用的所有核酸提取试剂开展提取核酸纯度、浓度、提取效率、提取过程重复性的研究,并评价该方法能否满足KRAS基因突变检测试剂的要求,提供详细的评价资料。
若产品适用可归结成两种或以上核酸提取试剂,则每种核酸提取试剂均需配合检测试剂开展精密度、检出限与抗干扰的验证。
2.9反应体系
2.9.1样本采集与处理
弄清楚样本的取材、固定、包埋、切片的具体要求,包括但不限于可检测标本的类型、样本离体后开始固定的时间、固定液的选择、温度要求、包埋条件、组织块的厚度要求等。提供样本处理的方法、步骤及参考的采集标准依据。
应确定样本中的最低肿瘤细胞含量,提交确定方法及研究数据,肿瘤细胞所占比例需达到所用扩增检测方法的要求。当样本中肿瘤细胞含量低于标准要求时,如需按照基于样本富集的方法来满足肿瘤细胞含量要求,应提交详细的样本富集方法、步骤及研究数据,并对该方法所制备样本开展精密度与检测限验证研究。
2.9.2核酸提取与反应体系
研究确定最佳核酸提取与反应体系,包括核酸提取用的样本体积、洗脱体积与PCR加样体积、各种酶浓度、引物/探针浓度、dNTPs浓度、阳离子浓度及反应各阶段温度、时间、循环数等。弄清楚每uL反应体系的DNA加样量与总DNA浓度确定方法,建议在保证核酸提取质量的情况下尽量扩大总反应体系与加样量,以提高检测灵敏度。
如有多个适用机型,需提供每个适用机型基线与阈值的确定资料。不同适用机型的反应条件要是有差异应分别详述,并提交验证资料。
3. 稳定性研究
包括实时稳定性(有效期)、运输稳定性、开封稳定性及冻融次数限制等研究,申请人可按照实际需要选择可靠的稳定性研究方案。稳定性研究资料应包括研究方法的确定依据、具体的实施方案、详细的研究数据以及结论。对于实时稳定性研究,应提供至少三批样品在实际储存条件下保存至成品有效期后的研究资料。
4. 阳性判断值研究
阳性判断值即为能够获得理想的检测准确性的临界值(Cut-off)。研究建议纳入一定数量的临床样本,涵盖人KRAS野生型与可检测的不同突变类型,按照基于受试者工作特征(ROC)曲线的方式开展研究,亦可按照基于其他科学可靠的方法开展阳性判断值研究。要是试剂判读存在灰区,应提交灰区范围确定的研究资料。提交阳性判断值形成及验证研究资料时,应包括研究方案、设定评价标准、研究过程以及研究原始数据等。其中,所用样本的背景信息列表应至少包括性别、年龄、临床诊断信息、样本来源机构、检测结果等信息。
5.其他资料
5.1主要原材料研究
此类产品的主要原材料应包括引物、探针、酶、dNTPs、核酸分离/纯化组分(如有)、质控品、企业参考品等。应提供主要原材料的选择与来源、制备过程、质量控制标准等相关研究资料、质控品的定值试验资料等。如主要原材料为企业自制,应提供其详细制备过程;如主要原材料源于外购,应提供资料包括:选择该原材料的依据及比较筛选试验资料、生产商提供的质量标准、出厂检验报告,以及该原材料到货后的质量检验资料。生产商应固定,不得随意更换。
5.1.1 引物与探针:
应详述每一待测位点检测用引物、探针的设计原则,分别提供引物探针序列、靶基因序列及两者的对应情况。建议设计两套或多套引物探针以供筛选,针对待测位点的检测灵敏度与特异性等开展评价,选择最佳引物探针组合,并提交详细的筛选研究数据。同时应针对引物、探针及检测靶序列与公开数据库开展同源性研究,如有同源序列应着重评价是否会有交叉反应。
申请人应针对选定的引物、探针原材料开展质量评价,一般包括:外观、分子量、纯度、浓度、序列准确度、探针荧光标记基团,以及功能性试验等,并依据评价结果形成可靠的质量标准。
5.1.2脱氧三磷酸核苷(dNTPs):包括dATP、dCTP、dGTP、dTTP或dUTP,应提交对其纯度、浓度、保存稳定性等的验证资料,以及功能性试验资料,并确定质量标准。
5.1.3酶:主要包括DNA聚合酶、尿嘧啶DNA糖基化酶(UDG/UNG)等,应分别对酶活性、热稳定性、功能性试验等开展评价与验证,并确定质量标准。
5.1.4质控品
试剂盒一般包括阴性质控品与阳性质控品。阳性质控品应包括较常见的突变序列或理论上较难测得的突变序列,可按照基于质粒、细胞系或临床样本的核酸提取液等开展制备。阴性质控品可按照基于含有野生型核酸序列的核酸溶液,也可按照基于不含待测靶序列的空白对照,对交叉污染结果的假阳性结果开展质控。阴性质控品应参与样本核酸的平行提取与检测的全过程。提交试剂盒质控品密切相关原料选择、制备、定值过程、浓度范围等试验资料,对质控品的检测结果Ct值范围做出弄清楚的要求。
5.1.5内标
内标,又称内对照,可以对管内抑制结果的假阴性结果开展质量控制,应与靶核酸一同提取及扩增。申请人需对内标的引物、探针与模板浓度做精确验证,既要保证内标荧光通道呈显著的阳性曲线又要尽量减少对靶基因检测造成的抑制。弄清楚内标的检测结果Ct值范围。建议科学设置内标,对待测样本的取样质量、试剂的反应体系开展监控。
5.1.6企业参考品制备
企业参考品一般包括阳性参考品、阴性参考品、检出限参考品与重复性参考品。应按照产品性能验证的实际需要设置企业参考品。
常见基因突变位点建议按照基于临床样本提取的DNA储备液作为原料,对于罕见基因突变类型可按照基于临床样本提取的DNA储备液、细胞系或质粒作为原料。企业参考品基质应与样本储存液基质一致。应提交企业参考品的原料来源、选择、制备、浓度、突变样本突变类型及突变百分率的确认方法或试剂等相关验证资料。企业参考品的设置建议如下:
阳性参考品:针对试剂盒检测范围内所有突变位点均应设置相应的阳性参考品,设置多个突变百分率梯度。
阴性参考品:应包括经确认无相应靶突变序列的样本(如野生型人基因组,RAS家族不同基因型等)、非人类基因组样本。
检出限参考品:针对试剂盒检测范围内所有突变位点均应设置相应的检出限参考品,其中每个突变位点应从扩增反应终体系总核酸浓度与突变序列所占百分率两个方面开展评价,可选择检出限水平(例如:95%检出率)或略高于检出限的水平的样本。
重复性参考品:应包括略高于检出限浓度水平的阳性样本、中或强阳性水平样本、阴性样本(野生型样本),其中阳性精密度参考品以常见突变类型或理论上较难测得的突变序列为主。
5.2生产工艺研究 生产工艺研究资料主要包括工作液配制(引物、探针浓度、酶浓度、dNTP浓度、缓冲液离子浓度等)、分装与冻干(如有)、荧光标记等工艺过程的描述及确定依据。生产过程应对根本参数开展有效控制,可按照基于流程图方式描述生产工艺,标注清楚根本工艺质控步骤,并详细说明该步骤的质控方法及质控标准。提交主要生产工艺的确定及优化研究资料。
(四)临床评价资料
人KRAS基因突变检测试剂针对结直肠癌适应证,预期用途为用于西妥昔单抗的伴随诊断。针对该预期用途,KRAS突变一般为2号外显子(密码子12与13)、3号外显子(密码子59与61)以及4号外显子(密码子117与146)的突变。申报产品所覆盖的突变位点,按照其不同突变位点的突变率,建议至少包括第2号外显子的第12号与13号密码子的7种热点突变,包括G12D、G12C、G12S、G12R、G12V、G12A、G13D。如产品设计所检测的突变位点少于以上位点,申请人应提供相关支持性资料,应按照突变位点的覆盖率,充分研究可靠性。
该类试剂应通过临床试验路径开展临床评价,临床试验包括产品临床检测性能研究与伴随诊断试剂临床意义研究两部分。临床试验应符合《体外诊断试剂注册与备案管理措施》《医疗器械临床试验质量管理规范》与《体外诊断试剂临床试验技术指导原则》的要求,如相关法规、文件有更新,临床试验应符合更新后的要求。
1.临床检测性能研究
1.1临床试验机构及人员
申请人应选择不少于3家经备案的临床试验机构开展临床试验。临床试验机构应常规开展结直肠癌分子病理检测,具有病理诊断、分子生物学检测的优势,试验操作人员应有足够的时间熟悉检测系统的各环节(仪器、试剂、质控及操作程序等),熟悉评价方案。临床试验整个过程均应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
1.2临床试验适用人群与样本类型
适用人群为经病理诊断为结直肠癌的人群。应注意纳入人群应覆盖结直肠癌不同分期与不同组织分型(腺癌、腺鳞癌、鳞癌等)的病例。阳性样本应包括一部分弱阳性的样本。
临床试验所用的样本类型应为病理质控合格的FFPE样本。如对于活检标本及手术标本均适用,则临床试验中对于可归结成两种标本均应纳入。临床样本的处理、保存与核酸提取等应分别满足申报产品说明书及比较试剂说明书的相关要求。
1.3比较方法选择
可选择实验室参考方法或已上市同类产品作为比较方法。参考方法的检测可在临床试验机构完成也可委托具有资质的第三方机构完成。已上市同类产品的选择应从预期用途、样本要求、检测性能、检测范围、所检突变是否可以分型等方面,确认其与申报产品具有较好的可比性。
如选择核酸序列测定方法作为此类试剂临床试验研究的比较方法,验证申报试剂检测结果与核酸序列测定(测序)结果之间的一致性情况,临床研究报告中应对选用的测序方法作详细介绍。
1.4临床试验样本量
临床试验样本量应按照基于适当的统计学方法开展估算,并详细描述所使用统计方法及各参数的确定依据。此部分临床试验目的为评估可归结成两种检测方法之间的一致性,因此建议按照基于单组目标值法开展最低样本量的估算。通过阳性符合率与阴性符合率来分别计算所需阳性样本与阴性样本的例数。样本量估算公式如下:
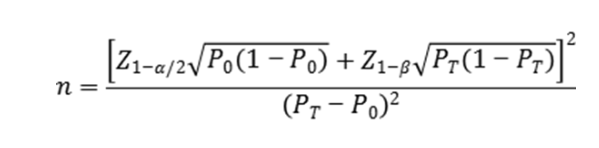
公式中,n为样本量;Z1、Z为显著性水平与驾驭度的标准正态分布的分数位,P为评价指标的临床可接受标准,P为申报产品评价指标预期值。
其中阳性符合率与阴性符合率的临床可接受标准(P)建议不低于95%。临床试验结果中,相关评价指标的95%置信区间下限应不低于预设的临床可接受标准。
基于申报产品的方法学为PCR方法,临床试验中应对所声称的每个突变位点均开展验证,且每个突变位点均应具有一定的阳性病例。对于临床罕见的突变位点,例数可酌情减少,申请人应提供相关的支持性资料。
临床试验总样本量确定时应在上述阴、阳性样本最低样本量估算的基础上,同时考虑其他可能造成受试者脱落的情况以及申报产品所覆盖的突变位点,按照实际情况适当增加入组样本量。
1.5统计研究
应针对所入组人群开展人口学研究,包括性别、年龄、治疗状态、组织分型、分期、样本类型、肿瘤细胞含量等方面开展研究,还应研究临床试验中所纳入的阳性判断值附近的样本情况。
以四格表分别总结申报产品与比较方法的定性检测结果,计算阳性符合率、阴性符合率及相应的95%置信区间。除总体统计外,还要针对每个突变位点开展统计研究,以验证申报产品与比较方法检测结果的一致性。
针对可归结成两种方法检测纷歧致样本,应按照基于可靠的方法开展确认,对纷歧致的原因综合开展研究。
2. 伴随诊断临床意义的确认
2.1临床试验机构数量
针对此部分临床研究,申请人应选择不少于3家按要求备案的临床试验机构开展临床试验。
2.2 临床试验设计及比较方法的选择
因KRAS基因突变对于西妥昔单抗的伴随诊断为负向位点,野生型可使用西妥昔单抗药物。因此可按照基于一致性比对的方式开展临床评价。
如申报试剂仅包括上述的7个热点突变,可按照基于与原研伴随诊断试剂开展比较研究,评价两者之间的一致性。
如申报试剂包括KRAS 2号外显子(密码子12与13)、3号外显子(密码子59与61)以及4号外显子(密码子117与146)的突变,则可与西妥昔单抗药物临床试验中所按照基于的CTA方法开展比较研究。可按照基于重建CTA的方式,应注意重建CTA的实验流程、检测性能应与CTA方法具有良好的一致性。
申报产品用于指导用药的灵敏度应与原研伴随诊断试剂相当,按照原研伴随诊断试剂的灵敏度水平设置相应的阳性判断值,以保证两者具有较好的一致性。
2.3入组人群
此部分临床研究的目的在于评价申报产品的伴随诊断的预期用途,因此所入组人群应以西妥昔单抗药物的适应证人群,即转移性结直肠癌为主。
样本量的估算方法与上述临床性能评价中的样本量估算方法一致,按照与原研伴随诊断试剂的一致性水平设置可靠的最低可接受标准。如原研伴随诊断试剂同时能够满足对申报产品临床检测性能的评价,则此部分研究可与第一部分临床检测性能的评价开展合并,但应注意入组人群的差异。
此部分研究中应按照适应证人群中的基因突变率纳入临床常见的突变位点。
2.4 其他
如申报产品所伴随药物为其他药物,则应按照伴随诊断试剂相关指导原则的要求提供伴随诊断证据。如申报产品为与新开发的抗肿瘤药物同步研发的伴随诊断试剂,则可提供与药物同步开发的药物临床试验资料作为其伴随诊断证据。药物临床试验报告中应弄清楚所使用的伴随诊断试剂为申报产品,并弄清楚申报产品在药物临床试验中所起的作用以及与药物疗效的关系。
3.通用要求
3.1临床试验方案
临床试验实施前,某学说学派应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学可靠的临床试验方案。各临床试验机构应执行同一临床试验方案,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。整个试验过程应在临床试验机构的实验室内并由本实验室的技术人员操作完成,申请人的技术人员除开展必要的技术指导外,不得随意干涉实验进程,尤其是数据收集过程。
试验方案中应确定严格的病例纳入/排除标准,任何已经入选的病例再被剔除出临床试验都应记录在案并弄清楚说明原因。在试验操作过程中与判定试验结果时应按照基于盲法以保证试验结果的客观性。
3.2质量控制
临床试验开始前,建议开展临床试验方案的培训,以熟悉并掌握相关试验方法的操作、仪器、技术性能等,最大限度控制试验误差。整个试验过程都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
3.3临床试验报告
临床试验报告应该对试验的整体设计及各个根本点给予清晰、完整的阐述,应该对整个临床试验实施过程、结果研究、结论等开展条理分明的描述,并应包括必要的基础数据与统计研究方法,最后得出临床试验结论。临床试验报告的撰写应参考相关法规的要求。
(五)产品说明书与标签样稿
产品说明书格式应满足《体外诊断试剂说明书编写指导原则》的要求。产品说明书中技术内容应与注册申报资料中的相关研究结果保持一致,如某些内容引用自参考文献,应以规范格式开展标注,并单独列明文献的相关信息。人KRAS基因突变检测试剂说明书编写应重点关注以下内容。
1.【预期用途】应至少包括以下几部分内容:
1.1试剂盒用于体外定性检测结直肠癌患者经10%中性福尔马林固定石蜡包埋(FFPE)样本中KRAS基因第X号外显子XX密码子的X个突变位点(弄清楚突变型别)。用于XX药物的伴随诊断。
1.2建议列表表述人KRAS多个基因突变型别,列明不同外显子中基因突变的排列顺序。至少弄清楚产品外显子、突变位点、cosmic ID、突变位点临床意义及人KRAS基因信息所使用的数据库。
1.3 人KRAS基因突变检测的目标人群:
1.4申报试剂应伴随特定肿瘤治疗药物联合开展临床试验研究,并证明两者伴随使用具有显著的临床治疗意义,说明书中需弄清楚具体药物通用名称,并简要介绍相关的临床患者受益情况。
1.5应介绍相关的临床背景,包括相关适用人群特征、肿瘤的组织类型、适用的样本类型、待测靶基因序列的特征及选择依据、靶基因及其表达蛋白在恶性肿瘤出现、发展过程中可能起到的作用、相关药物或其他治疗技术及其作用机理、与待测突变位点可能存在的关系等。
1.6弄清楚说明该试剂盒仅用于对结直肠癌患者靶基因序列的检测,其检测结果仅供临床参考,不应作为患者个体化治疗的唯一依据,临床医生应结合患者病情、药物适应症、治疗反应及其他实验室检测指标等因素对检测结果开展综合判断。
2. 【检验原理】
2.1对试剂盒检测能够覆盖的所有突变位点或突变类型、内标基因开展详细描述(靶序列长度、基因座位、突变类型及相关特征等),对引物及探针设计、不仍然品反应管组合、质控品设置及荧光信号检测原理等开展逐项介绍。
2.2详细介绍核酸分离/纯化方法、原理等(如适用)。
2.3如反应体系中添加了相关的防污染组分(如UDG/UNG等),也应对其作用机理作适当介绍。
3.【样本要求】重点弄清楚以下内容:
样本的采集、处理、运送与保存:弄清楚对适用样本的取材、固定、包埋的具体要求,可参考国内相关标准操作性文件内容开展编写或引用。弄清楚样本中肿瘤细胞含量的要求,弄清楚低于声称肿瘤细胞含量样本的处理方式。弄清楚样本核酸提取/纯化前的预处理过程、保存条件及期限、运输条件等。
4.【检验方法】详细说明实验操作的各个步骤,包括:
详细说明实验操作的各个步骤,包括:
4.1 FFPE组织样本脱蜡过程,应分别描述封固于载玻片与未封固于载玻片(如有)的脱蜡步骤。
4.2试剂配制方法、注意事项。
4.3核酸分离/纯化的条件、步骤及注意事项。质控品应参与样本核酸的平行提取,以对核酸分离/纯化环节开展可靠的质量控制,弄清楚提取核酸的浓度纯度等质量要求。
4.4扩增反应前准备:各组分加样体积、顺序、相关注意事项等。
4.5 PCR各阶段的温度、时间设置、循环数设置及相关注意事项。
4.6仪器及软件设置:特殊参数,待测基因、内标与质控品的荧光通道选择等。
5.【检验结果的解释】
结合质控品、内标以及样本管检测结果的Ct值,以列表的形式对所有可能出现的结果组合及相应的解释开展详述。如存在检测灰区,应详述对于灰区结果的处理方式。
6.【检验方法的局限性】
6.1本试剂盒的检测结果仅供临床参考,对患者个体化治疗的选择应结合其症状/体征、病史、其他实验室检查及治疗反应等情况综合考虑。
6.2阴性结果不能完全排除靶基因突变的存在,样本中肿瘤细胞过少、核酸过度降解或扩增反应体系中靶基因浓度低于检出限亦可造成阴性结果。
6.3肿瘤组织(细胞)可能存在较大异质性,不同部位取样可能会得到不同的检测结果。
6.4不可靠的样本采集、转运及处理,以及不当的试验操作与实验环境均有可能结果假阴性或假阳性结果。
6.5弄清楚该检测仅限于规定的样本类型及检测系统(包括适用机型、核酸分离/纯化试剂、检测方法等)。
6.6本检测试剂的检测范围仅包括检测试剂声称的基因突变位点范围,不包括检测试剂盒声明之外的基因突变位点的检测。
7【产品性能指标】详述以下性能指标:
7.1对国家参考品与企业参考品的符合情况。
7.2检出限:说明在试剂盒规定的检测条件及扩增体系中,试剂盒能够覆盖的所有突变类别的最低检出浓度。重点考虑原始模板中基因突变的百分率与扩增终体系中核酸浓度两个因素对最低检出限的影响,并简单介绍最低检出限的确定方法。
7.3对精密度的研究情况开展总结。
7.4研究特异性
7.4.1交叉反应:详述交叉反应验证的基因类型、病原体种类,及有/无交叉反应的浓度水平。
7.4.2干扰试验:说明验证的干扰物质种类及有/无干扰反应的浓度水平。
7.5临床试验:简要介绍试验方法、受试者及样本、试验结果与结论等。
8【注意事项】
8.1本产品仅用于体外诊断。
8.2临床实验室应严格按照《医疗机构临床基因扩增实验室管理措施》等密切相关分子生物学实验室、临床基因扩增实验室的管理规范执行。
8.3试剂保存运输及使用过程中多种因素可能结果性能变化,如保存运输不当、样本采集、样本处理及检测过程操作不规范等,请严格按照说明书操作。
8.4生物安全防护相关内容。
8.5避免实验室污染的措施。
参考文献:
[1] 袁瑛,张苏展.结直肠癌分子标志物临床检测中国专家共识[J].中华胃肠外科杂志, 2021(003):024.
[2] Manne U , Putcha B D K , Samuel T ,et al.Prognostic and Predictive Biomarkers for Colorectal Cancer[J].John Wiley & Sons, Ltd, 2017.DOI:10.1002/9781118468869.ch13.
[3] Douillard JY, Oliner KS, Siena S et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013; 369: 1023-1034.
[4] Lievre A, Bachet JB, Le Corre D et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66: 3992-3995.
[5] De Roock W, Jonker DJ, Di Nicolantonio F et al. Association of KRAS p.G13D mutation with outcome in patients with chemotherapy-refractory metastatic colorectal cancer treated with cetuximab. JAMA 2010; 304: 1812-1820.



 1408
1408

