本指导原则旨在指导注册申请人对结直肠癌筛查试剂临床评价资料的准备及撰写,同时也为技术审评部门对临床评价资料的技术审评提供参考。
本指导原则是针对结直肠癌筛查试剂临床评价的一般要求,该类试剂应通过临床试验路径开展临床评价,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容开展充实与细化。
本指导原则是供注册申请人与技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。要是有能够满足相关法规要求的其他方法,也可以按照基于,然而需要提供详细的研究资料与验证资料。
本指导原则是在现行法规与标准体系以及当前认知水平下制定,随着法规与标准的不断改进,以及科学技术的不断发展,相关内容也将适时开展调整。
一、适用范围
本指导原则适用于对来源于人粪便样本中的相关标志物开展体外检测,用于结直肠癌筛查的体外诊断试剂。阳性结果提示可能存在结直肠癌或进展期腺瘤,应开展诊断性结肠镜检查;阴性结果不能完全排除疾病风险,尤其是针对高风险人群,必要时仍应建议开展结肠镜检查。产品检测结果不能替代结肠镜。对于其他样本类型,可能部分要求不完全适用或本文所述内容不够全面,申请人可以参照本指导原则,按照产品特性对适用部分开展评价或补充其他的评价资料开展相应验证。
二、临床试验注册审查要点
开展结直肠癌筛查试剂临床试验应符合《体外诊断试剂注册与备案管理措施》《医疗器械临床试验质量管理规范》以及《体外诊断试剂临床试验技术指导原则》的要求,如相关法规、规章、规范性文件有更新,临床试验应符合更新后的要求。
申请人应按照产品特点确定适用人群,临床试验入组人群应对产品适用人群总体具有良好的代表性。应选择不少于3家(含3家)符合法规要求的临床试验机构开展多中心临床试验。
参与临床试验的人员经培训后应熟悉相关检测技术的原理、预期用途、操作方法等,并能够对检测结果开展正确判读。在整个试验中,试验体外诊断试剂与比较试剂/方法都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
临床试验应包括:对目标人群的筛查性能评价;对结直肠癌及进展期腺瘤诊断的灵敏度与特异度的分层评价;被测标志物的检测性能评价等。
(一)对目标人群的筛查性能评价
1.受试者入组
筛查临床试验应在预期适用的目标人群中按照临床试验方案设定的入组标准前瞻性入组受试者。
结直肠癌筛查试剂的适用人群可能为一般风险人群或满足一定年龄、性别要求的全人群,也可以是通过适当的判定标准选择的高风险人群。应弄清楚适用人群的判定依据。密切相关高风险人群与一般风险人群的定义建议按照现行有效的筛查指南执行。
入组人群应具有良好的目标人群代表性,包括人群基本特征与结直肠癌相关高风险因素的分布等方面。
受试者有无高风险因素等临床背景信息应在临床试验数据表中开展描述,建议针对每一项风险因素单独设一列。
因为保证入组受试者代表性与临床试验可操作性,可委托社区卫生服务机构、乡(镇)卫生院、基层疾病预防控制机构等开展受试者招募,注意应由临床试验机构开展委托,临床试验机构应对临床试验整体质量控制、临床试验数据的真实性与合规性负责;临床试验中的检测研究(包括试验体外诊断试剂检测、比较方法或临床参考标准涉及的检测等)、数据管理及统计研究应由临床试验机构完成;受试者招募、知情同意书签署、样本采集等基础操作过程可由社区卫生服务机构等完成;密切相关任务分工等应在临床试验方案中弄清楚,由审查该临床试验的伦理委员会审查批准;临床试验机构应形成相关管理制度,弄清楚各方职责,加强培训与管理,确保临床试验结果真实、准确、完整与可追溯。
2.试验方法
按照基于试验体外诊断试剂与结直肠癌与进展期腺瘤临床诊断参考标准,即结肠镜结合病理检查结果开展比较研究,评价试验体外诊断试剂在适用人群中筛查结直肠癌与进展期腺瘤的灵敏度、特异度与阳性/阴性预测值等指标。
因为对筛查试验结果开展更加科学的研究,临床试验中建议同时按照基于现行指南推荐的、与试验体外诊断试剂的应用场景具有较好可比性的已有筛查方法(如粪便潜血检测等)开展筛查,并将可归结成两种筛查方法的临床性能指标开展比较研究。即受试者入组后按照基于试验体外诊断试剂与现行指南推荐的筛查方法分别开展检测,之后开展结肠镜检查,必要时开展病理检查。试验体外诊断试剂与已有筛查方法的样本采集应在结肠镜检查之前完成。
3.样本量
应按照预期灵敏度水平,按照基于单组目标值法样本量公式估算最低结直肠癌样本例数。
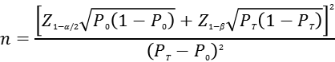
公式中,n为阳性样本量;Z、Z为显著性水平与驾驭度的标准正态分布的分位数,P为评价指标的临床可接受标准,P为试验体外诊断试剂评价指标预期值。
基于已有认知,结直肠癌灵敏度P建议不低于80%。
按照估算的最低结直肠癌样本例数与预期适用人群中结直肠癌患病率估算总样本量,同时考虑可能的受试者脱落比例,确定需要入组的受试者最低总样本量。
4.统计学研究
应对入组人群基线信息开展总结研究,包括人口学信息,如年龄、性别、常住地域(农村,城市),以及风险因素分布等。入组人群应具有良好的目标人群代表性。
建议按照基于流程图的形式说明入组人群、脱落人群、纳入统计人群的情况,并对所有脱落病例开展研究,解释脱落原因与脱落率可接受的理由。如有必要应开展脱落前后人群的基线差异研究。
最后对筛查试验的各项临床性能指标开展研究。评价指标一般包括临床灵敏度、临床特异度、阳性预测值、阴性预测值等。其中临床灵敏度应针对结直肠癌与进展期腺瘤病例组分别评价,临床特异度应针对非结直肠癌且非进展期腺瘤受试者开展评价。应针对各项评价指标开展点估计值及95%置信区间计算。此外计算入组人群中结直肠癌患者占比,应与同时期流行病学调查结果相符,同时计算各分期患者占比。
临床试验结果汇总与各项指标计算方法参见表1。
表1临床试验检测结果总结
试验体外诊断试剂检测结果 | 结肠镜结合组织病理学检查结果 | ||||
结直肠癌 | 进展期腺瘤 | 其他腺瘤 | 无显著发现 | 合计 | |
阳性 | a | b | c | d | a+b+c+d |
阴性 | e | f | g | h | e+f+g+h |
合计 | a+e | b+f | c+g | d+h | N |
注:1.其他腺瘤:不属于进展期腺瘤的其他腺瘤或无蒂锯齿状病变。
2.无显著发现:非肿瘤病变等阴性病变及结肠镜检查无病变。
结直肠癌临床灵敏度=a/(a+e)×100%
进展期腺瘤临床灵敏度=b/(b+f)×100%
其他腺瘤检出率=c/(c+g)×100%
临床特异度=(g+h)/(c+d+g+h)×100%
阳性预测值=(a+b)/(a+b+c+d)×100%
阴性预测值=(g+h)/(e+f+g+h)×100%
如适用人群为满足一定年龄、性别要求的人群,建议针对其中的一般风险人群与高风险人群开展分层研究,确认不同人群的筛查性能均满足临床要求。
产品如包括多项标志物,可针对各项标志物及多项标志物联检的筛查灵敏度开展研究,确认多项标志物联合检测的意义(如适用)。要是试验体外诊断试剂不适用于此项评价,应有充分的理由。
建议同步开展已有筛查方法检测,参照上述方法评价各项临床性能指标。将试验体外诊断试剂的各项临床性能指标与已有筛查方法比较。
(二)结直肠癌及进展期腺瘤灵敏度与特异度的分层评价
1.受试者入组
为更加充分的评价试验体外诊断试剂的灵敏度与特异度,还应对肿瘤组与非肿瘤组的重要亚组分别开展分层研究,使临床性能评价更加全面地覆盖目标人群中的各种特征,包括不同分期的肿瘤病例,与不同干扰因素的非肿瘤病例等。如前瞻性入组病例中某些亚组样本量不足可进一步富集入组,富集入组病例不纳入(一)部分的筛查性能评价。
1.1疾病组
疾病组人群应包括结直肠癌不同分期(Ⅰ、Ⅱ、Ⅲ、Ⅳ期)、结直肠进展期腺瘤患者,并针对不同亚组灵敏度开展分层研究。
1.2非疾病组
为对产品临床特异度开展充分评价,应纳入肠道良性疾病患者(肠息肉、肠腺瘤、肠炎、肠黑变病等)与其他消化道癌症患者包括胃癌、肝癌、食管癌、胆管癌、胰腺癌等。
2.试验方法
按照基于试验体外诊断试剂与临床诊断参考标准开展比较研究,评价试验体外诊断试剂针对结直肠癌各分期、进展期腺瘤疾病组的临床灵敏度,以及消化道良性疾病、其他肿瘤亚组的临床特异度等指标。
3.临床评价指标与样本量
评价指标包括临床灵敏度、临床特异度以及各亚组的临床灵敏度、临床特异度。
依据临床需求与已报道研究数据,部分根本亚组临床性能评价指标推荐的最低可接受标准(95%置信区间下限)参下表:
表2部分亚组临床性能评价指标推荐最低可接受标准
亚组 | 评价指标 | 预期可接受标准 |
结直肠癌 | 临床灵敏度 | 80% |
进展期腺瘤 | 临床灵敏度 | 40% |
其他腺瘤 | 临床特异度 | 80% |
其他恶性肿瘤 | 临床特异度 | 80% |
肠道无显著发现 | 临床特异度 | 90% |
按照已有文献数据,经统计学估算,建议结直肠癌病例不少于200例,其中各分期病例均应有一定例数,建议Ⅰ期不少于80例,Ⅱ期不少于50例;胃癌、肝癌、食管癌建议分别不少于30例,其他各种消化道癌症亦均应有病例入组且总例数建议不少于30例。
4.统计学研究
对临床试验结果开展总结。计算灵敏度、特异度并计算95%置信区间;同时应针对结直肠癌不同分期、以及进展期腺瘤患者分别计算灵敏度;针对不同类型肠道良性疾病患者、其他不同癌种病例以及肠道无显著发现患者分别研究特异度。
对于检测结果与临床诊断结论纷歧致的样本,应结合患者疾病背景信息、其他临床实验室检验结果等对差异原因开展可靠研究。
(三)被测标志物检测性能评价
1.试验方法
按照被测标志物的特征,应按照基于试验体外诊断试剂与已上市同类产品或实验室参考方法开展比较试验,评价试验体外诊断试剂针对被测标志物的检测性能。例如被测标志物为DNA甲基化或者基因突变,可以按照基于测序方法作为实验室参考方法,开展比较试验。如选择同类产品,应确认具有良好的可比性。实验室参考方法应开展充分的性能验证,包括最低检出限、准确性、精密度等,确认与试验体外诊断试剂具有良好的可比性,并提供详细的方法形成与性能验证资料。如测序试验委托第三方实验室或检测机构完成,应提供临床试验机构委托该试验的委托协议。
当试验体外诊断试剂包括多项被测物时,原则上应针对所有标志物分别开展检测性能评价。如不适用,应提供充分的理由与依据,并按照基于可靠的方法开展检测性能评价。
2.样本量
应针对所有标志物(如适用)分别估算阳性样本量与阴性样本量,建议按照基于单组目标值法公式,目标值(P)设定应有可靠依据,基因突变或甲基化等核酸标志物检测目标值建议不低于90%。
3.评价指标与统计学研究
对于试验体外诊断试剂与比较试剂/方法的一致性评价,可按照基于四格表的形式总结可归结成两种试剂/方法的检测结果,计算阳性符合率、阴性符合率、总符合率及其95%置信区间。
对于纷歧致样本,应开展原因研究。
(四)其他评价
在对申报产品各项临床性能开展充分评价的基础上,如有必要,申请人还可结合试验体外诊断试剂预期用于目标人群的成本效果比以及受试者接受度等开展综合研究,评价产品对筛查人群可能带来的风险与获益,并与已有筛查方法的风险与获益开展比较,评价申报产品的优势。此外建议申请人持续关注筛查频率对筛查效果的影响。
(五)临床试验质量控制
1.方案设计的偏倚控制
不同的入组方式与入排标准会带来入组人群的分布特征差异。为保证入组人群对筛查目标人群总体具有良好的代表性,临床试验方案应设置可靠的入排标准,应研究目标人群的分布特征以及患病率等流行病学数据,以保证临床试验各人群占比结构可靠性,避免带来入组人群的选择偏倚。
2.试验实施质量控制
控制脱落率是保证临床试验质量与结论可靠性的基本要求。应关注受试者招募与入组,通过各种方式控制脱落率不能过高。对于临床试验中的脱落情况应详细记录原因,研究脱落人群的特征,以研究脱落对临床试验的影响。
良好的结肠镜检查质量与息肉活检率是准确的临床诊断参考标准的有效保证。结肠镜检查质量应符合临床公认的高质量检查标准,即良好的肠道准备、盲肠插镜以及退镜时间至少6分钟。结肠镜息肉均应开展活检。
应注意试剂检测与结肠镜检查的时间间隔。试验体外诊断试剂与已有筛查方法(如按照基于)的样本采集应在结肠镜检查之前完成,与结肠镜检查的时间间隔建议不超过12周,以减少偏倚风险,保障数据的可比性与结果的科学性。
四、参考文献
[1]国家市场监督管理总局.体外诊断试剂注册与备案管理措施: 国家市场监督管理总局令第48号[Z].
[2]国家药品监督管理局 国家卫生健康委员会.医疗器械临床试验质量管理规范:国家药品监督管理局 国家卫生健康委员会2022年第28号[Z].
[3]国家药品监督管理局.体外诊断试剂临床试验技术指导原则:国家药品监督管理局2021年第72号[Z].
[4]中国结直肠癌筛查与早诊早治指南 (2020,北京)[Z].
[5]中国结直肠癌诊疗规范(2023年版)国家卫生健康委员会[Z].
[6]结直肠癌筛查与早诊早治方案(2024年版)国家卫生健康委员会[Z].
[7]U.S. Preventive Services Task Force. Screening for Colorectal Cancer. US Preventive Services Task Force Recommendation Statement. JAMA. 2021;325(19):1965-1977.
[8]Wild CP ,Weiderpass E, Stewart BW. World Cancer Report: Cancer Research for Cancer Prevention.
[9]詹思延. 流行病学[M]. 第8版.人民卫生出版社, 2017.


 1135
1135

