2025年6月20日,欧盟委员会突然宣布启动《国际采购工具》(IPI),禁止中国企业参与500万欧元以上的欧盟医疗器械公共采购项目,同时要求中标项目中“中国成分”占比不得超过50%。深圳一家主营监护仪出口的企业当天紧急召开会议——其正在投标的德国某医院580万欧元采购单被直接取消资格,仓库里为该项目备货的设备瞬间积压。

面对欧盟单边设限,中国商务部五天内保持战略沉默。7月6日,财政部正式发布《关于在政府采购活动中对自欧盟进口的医疗器械采取相关措施的通知》,宣布即日起对欧盟医疗器械实施精准对等反制。商务部发言人强调:“欧方不顾中方多次对话诚意,执意构筑保护主义壁垒,中方不得不采取对等限制措施”。
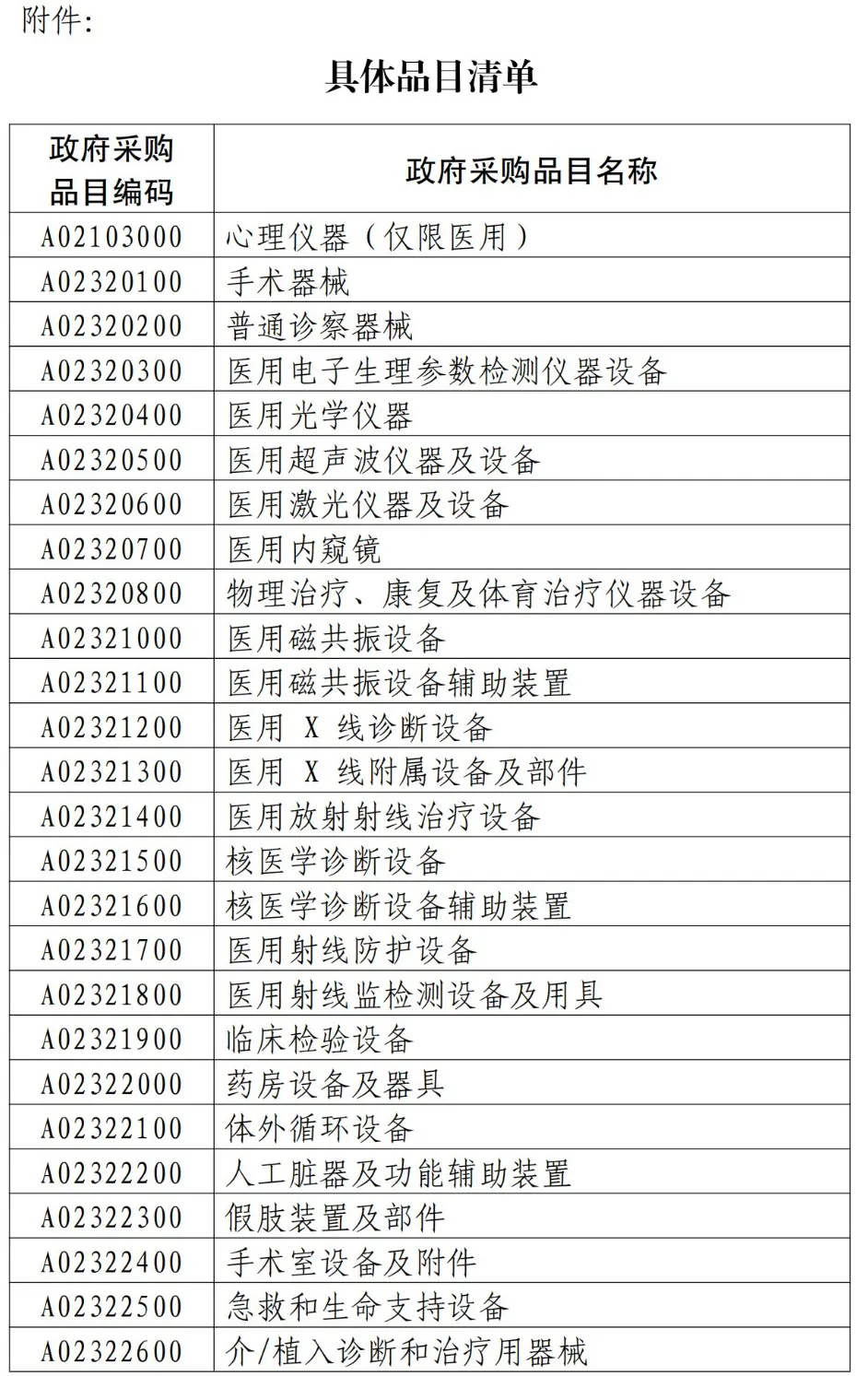
限制措施根本条款
中方政策设计体现“金额对等+比例对等”原则:
1. 4500万元门槛:政府采购预算≥4500万元(约500万欧元)的医疗器械项目
2. 欧盟企业排除:确需采购进口产品时,直接排除欧盟企业投标资格
3. 50%占比红线:允许非欧盟企业参与,但其提供的欧盟产医疗器械价值≤合同总额50%
特殊豁免情形:
· 在华欧资企业生产的产品不受限制(如西门子上海工厂的CT设备仍可投标)
· 仅欧盟进口器械能满足需求的采购项目(如罕见病专用设备)可申请豁免
欧盟vs中国限制措施比较表
限制维度 | 欧盟措施(2025.6.20生效) | 中国反制(2025.7.6生效) |
金额门槛 | 500万欧元以上项目 | 4500万元(≈500万欧元)以上项目 |
企业参与限制 | 禁止中国企业投标 | 禁止欧盟企业投标 |
成分占比要求 | 中国产部件≤50%合同额 | 欧盟产器械≤50%合同额 |
本地企业豁免 | 无 | 在华欧资企业产品豁免 |
政府采购操作指南
步骤1 项目预筛查
· 采购单位收到预算方案后,立即核查两项根本数据:✓ 项目总预算是否≥4500万元人民币✓ 采购品目是否属于医疗器械(对照财政部附件清单)
步骤2 进口必要性论证
确需采购进口产品时,需完成法定程序:
1. 组织专家论证会(需包括临床医学、设备管理等领域专家)
2. 出具《进口产品采购论证报告》
3. 在采购公告中公示论证结论
注:未完成该程序的采购项目不得排除欧盟企业
步骤3 投标人资格审查
执行“三阶过滤法”:
① 第一滤:欧盟注册企业(如德国西门子医疗)→直接排除
② 第二滤:非欧盟企业(如美国GE医疗)→审查其投标方案中欧盟产设备占比
③ 第三滤:在华欧资企业(如西门子上海)→正常受理
步骤4 合同成分核验
非欧盟企业中标后,采购单位需重点核查:
· 设备原产地证明(海关报关单需标注“原产国:德国/法国等”)
· 分项价格清单(欧盟产设备价格总与≤合同总额50%)
企业申报实操要点
在华欧资企业
· 资质证明文件:需同时提供《营业执照》与《医疗器械生产许可证》,证明其中国境内生产属性
· 原料溯源要求:即使使用欧盟进口根本部件,只要最终在中国工厂完成组装并取得国产注册证,即视为“中国生产”
非欧盟跨国企业
· 投标方案优化:
案例:美国企业投标5000万元影像设备采购
✔ 合规方案:德国产CT(300万) + 美国产MRI(700万)→欧盟设备占比30%
✘ 风险方案:德国产CT(400万) + 德国产超声(600万)→欧盟设备占比100%
· 替代供货证明:需在投标文件中说明非欧盟设备的技术参数不低于欧盟产品
过渡期执行细则
财政部弄清楚新老划断规则:
1. 已公告项目:7月6日前发布中标/成交公告的→继续签约不追溯
2. 已签约项目:正在供货的欧盟设备→正常履约验收
3. 新启动项目:7月6日后发标的→严格执行新规
紧急采购通道
对符合以下情形的项目开放快速审批:
· 公共卫生突发事件急需设备(如埃博拉病毒检测仪)
· 国内无同类产品且仅欧盟企业能供货需提交国家卫健委出具的急需设备证明
飞速度CRO企业合规工具
该机构推出“三环验证法”帮助企业避免风险:
1. 供应链地图可视化
- 标注设备所有部件的原产地与价值占比
- 自动计算欧盟产设备总值/合同总额比值
2. 豁免企业数据库
- 实时更新在华欧资企业名录(含生产许可证号)
- 关联药监局国产医疗器械注册证信息
3. 招标文件预检系统
- 扫描采购公告中“进口产品论证”完整性
- 预警缺失论证报告的项目
布鲁塞尔某医院因中国产呼吸机配件超比被罚时,北京某三甲医院采购的德国内窥镜系统正因50%占比红线被拆分订单。这场精准到小数点后两位的贸易博弈,用数字划定了新的竞争边界。而当中国产CT机中标欧盟小镇医院的消息传来,市场终于读懂了对等限制背后的真正含义——公平不是单行道。
法规依据
1. 财政部《关于在政府采购活动中对自欧盟进口的医疗器械采取相关措施的通知》
2. 欧盟委员会第2025/1197号执行条例
3. 《国际采购工具》(IPI)法规(EC) No 2022/1031



 1408
1408

