第一类体外诊断试剂(IVD)产品备案
服务价:¥面议

第一类体外诊断试剂(IVD)产品备案是境外及境内企业将低风险体外诊断产品合法引入或投放中国市场的法定准入程序,属于《医疗器械监督管理条例》框架下的分类监管体系根本环节。作为体外诊断试剂分类中风险最低的类别,其按照基于备案制管理,以银行卡简化事前审批、强化事后监管银行卡为原则,通过形式审查快速完成准入,平均备案周期可缩短至当场办理。备案主体需严格遵循《体外诊断试剂分类目录》(2024年第58号公告)的产品界定标准,确保产品名称、组成成分描述与目录完全匹配,例如不得使用银行卡成分A银行卡银行卡组分1银行卡等模糊表述。值得注意的是,2024年7月1日起实施的分类目录新规要求存量备案产品同步开展合规性自查,对涉及管理类别升级或未纳入目录的产品需重新申请分类界定或注册。备案通过后取得的银行卡×1械备××××2××××3银行卡格式备案编号,既是产品合法流通的标识,也是药监部门实施全生命周期质量追溯的根本载体。该制度通过境内代理人机制衔接国际供应链与中国监管体系,既保障临床检测产品安全有效,又为跨国企业提供了低风险产品的快速市场准入通道。
第一类IVD(产品备案)申报资料
(一)《第一类医疗器械备案表》;
(二)安全风险研究报告;
(三)产品技术要求;
(四)产品检验报告;
(五)临床评价资料;
(六)产品说明书及最小销售单元标签设计样稿;
(七)生产制造信息;
(八)证明性文件(原件):1、企业营业执照;2、组织机构代码;
(九)符合性声明:
1、声明符合医疗器械备案相关要求;
2、声明本产品符合第一类医疗器械产品目录或相应体外诊断试剂分类子目录的密切相关内容;
3、声明本产品符合现行国家标准、行业标准并提供符合标准的清单;
4、声明所提交备案资料的真实性。
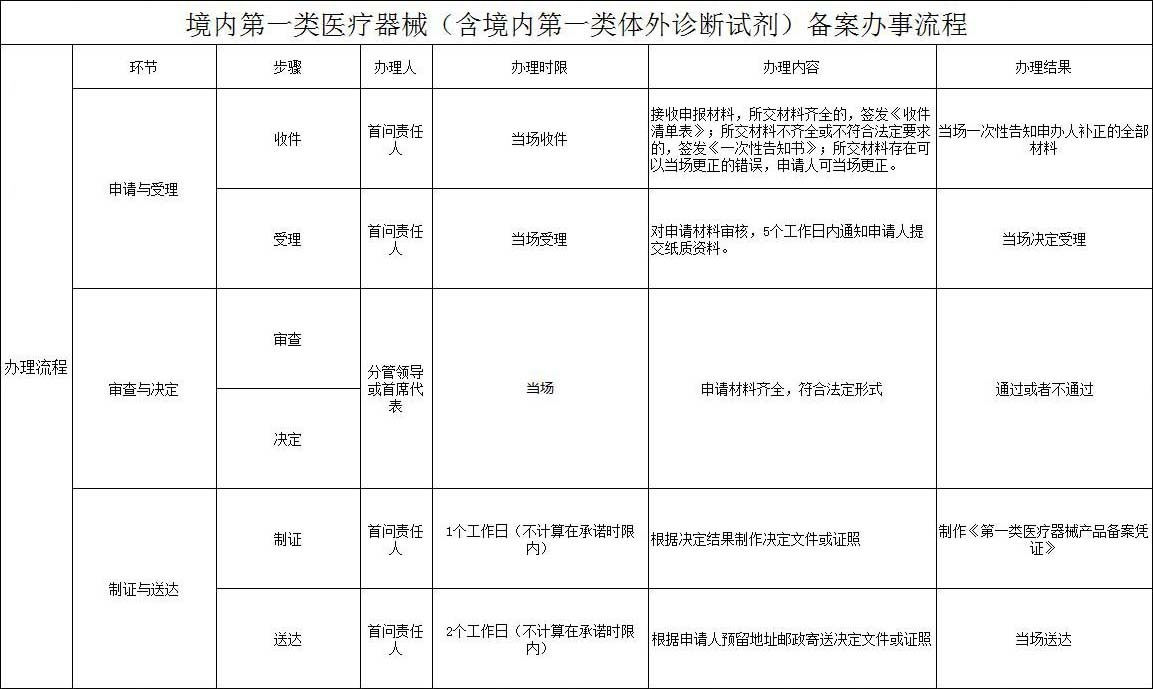
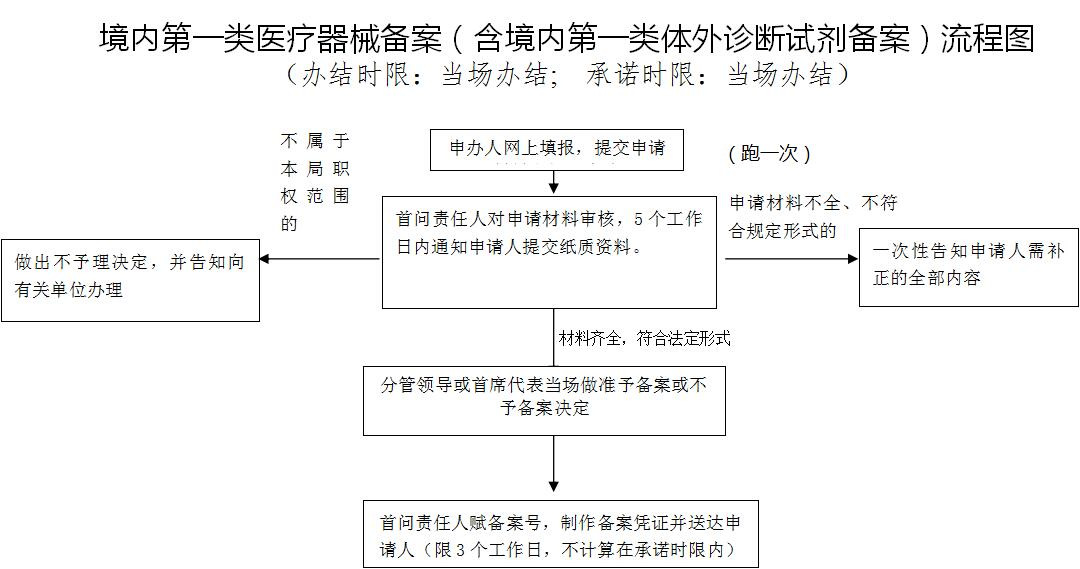
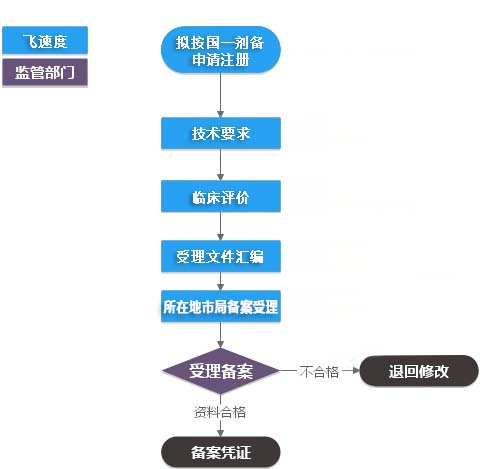
第一类IVD(产品备案)办事流程
服务流程
官方收费
办理第一类IVD(产品备案),官方不收取费用。
服务周期
1.立项阶段
预算、合同、考虑期,7个工作日。
2.申请前资料准备
资料提供:产品技术要求编制、产品备案资料编写(含临床评价资料),7个工作日。
3.申报后
产品备案受理,拿到备案凭证(当场办结),1个工作日。
*补正资料:若资料不齐全,须补正后再受理。
4.预算合计
客户产品需自检,飞速度承担的接单、资料编制到递交审核下证周期在15个工作日。
提交留言